摘要:一項臨床前研究,可能很快就可以確定哪些肝癌患者會從免疫治療中受益。
根據威爾康奈爾醫學研究人員的一項臨床前研究,可能很快就可以確定哪些肝癌患者會從免疫治療中受益。
這項研究發表在10月17日的《分子細胞》(Molecular Cell)雜志上,為一對名為p62和NBR1的蛋白質提供了新的見解,以及它們在調節肝星狀細胞干擾素反應中的相反功能,肝星狀細胞是肝臟對抗腫瘤的關鍵免疫成分。該研究表明,這些特化細胞中高水平的免疫抑制NBR1可能會識別出不太可能對免疫療法產生反應的患者。該研究還表明,在動物模型中,降低nbr1的策略有助于縮小腫瘤,這為那些對免疫治療無反應的患者提供了一種潛在的新治療方法。

圖1 NBR1和p62對肝星狀細胞STING通路的反向調節決定了肝細胞癌的進展
Jorge Moscat博士說:“P62和NBR1是陰陽。與NBR1相反,如果p62在肝星狀細胞中含量高,患者就不會患癌癥,但如果p62含量低,免疫系統就會被破壞。如果NBR1高,免疫系統就會受損,但如果NBR1低,免疫反應就會增強。”
直到最近,肝細胞癌患者幾乎沒有治療選擇,而那些可用的治療只能延長幾個月的生命。免疫療法為這些患者提供了一種新的選擇,并可能延長他們的生命長達兩年。
“肝臟是一個免疫功能受到極大抑制的器官,”聯合首席研究員Maria Diaz-Meco博士說。“重新激活免疫系統是一種非常有吸引力的方法,現在正在取得成果。”
然而,并非所有患者對免疫療法都有反應,只有一小部分患者實現了長期緩解。臨床醫生目前無法預測哪些患者會受益。她說:“我們需要生物標志物來確定哪些患者會有反應,哪些患者會獲得長期生存。”
Drs Moscat和Diaz-Meco與共同第一作者Sadaaki Nishimura博士和Juan F. Linares博士(分別是威爾康奈爾醫學院病理學和實驗室醫學系的博士后和講師)以及Antoine L'Hermitte博士(前Sanford Burnham Prebys醫學發現研究所)合作進行了這項研究。
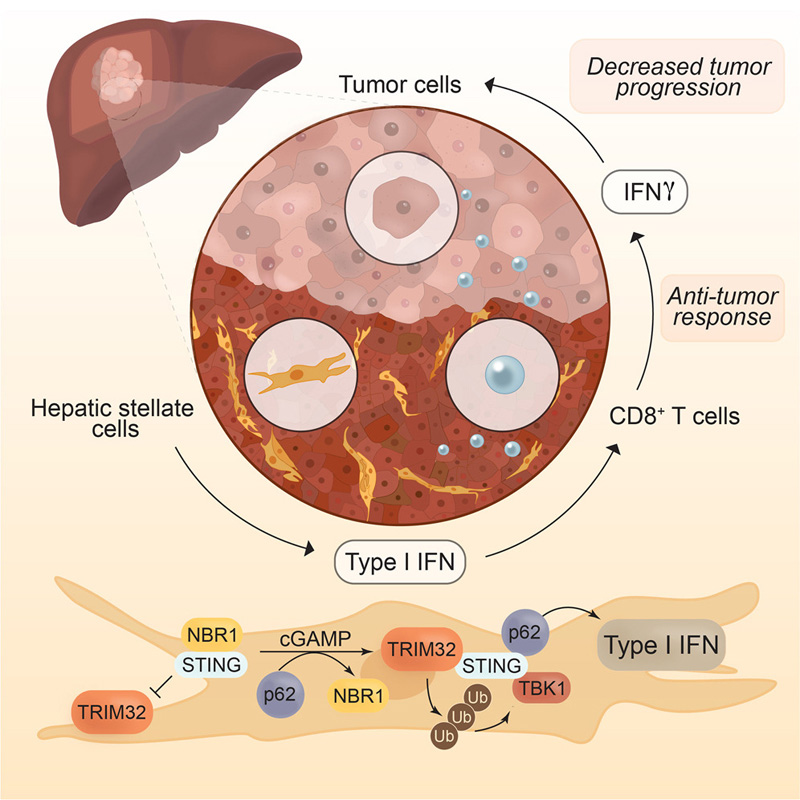
圖2 p62通過促進HSC中第三方基序蛋白32(TRIM32)的STING泛素化來激活干擾素(IFN)級聯
研究人員旨在通過研究導致癌癥的肝臟愈合機制中出現的問題來確定生物標志物和潛在的治療靶點。先前的研究發現,在肝癌患者中,腫瘤抑制蛋白p62的水平不可逆轉地降低。這項新研究表明,通常情況下,p62通過激活一種叫做STING的蛋白質來促進免疫反應,這種蛋白質會將NBR1推開,引發一種破壞腫瘤細胞的免疫反應。相比之下,NBR1促進STING的分解并阻斷免疫反應。從肝細胞癌小鼠的肝星狀細胞中刪除NBR1,即使p62水平保持在低水平,也能恢復免疫反應并縮小腫瘤。
該團隊目前正在研究如何開發一種療法,使患者體內的NBR1降解,并阻止其與STING相互作用。目標是重新激活免疫系統,幫助提高免疫治療的有效性。激活STING的藥物也在開發中,可能會提供另一種方法來幫助增強肝細胞癌患者的免疫反應。該團隊還將研究敲除NBR1是否有助于防止多種癌癥的轉移或防止腫瘤對治療產生耐藥性。
Moscat和Diaz-Meco博士計劃繼續研究調節肝臟免疫反應的途徑。
“如果我們不能完全理解調節這些過程的分子機制,免疫療法就不會取得進展,我們也無法理解為什么它對一些病人有效,而對另一些病人無效,”Diaz-Meco博士說。
參考資料
[1] Opposing regulation of the STING pathway in hepatic stellate cells by NBR1 and p62 determines the progression of hepatocellular carcinoma
摘要:一項臨床前研究,可能很快就可以確定哪些肝癌患者會從免疫治療中受益。
根據威爾康奈爾醫學研究人員的一項臨床前研究,可能很快就可以確定哪些肝癌患者會從免疫治療中受益。
這項研究發表在10月17日的《分子細胞》(Molecular Cell)雜志上,為一對名為p62和NBR1的蛋白質提供了新的見解,以及它們在調節肝星狀細胞干擾素反應中的相反功能,肝星狀細胞是肝臟對抗腫瘤的關鍵免疫成分。該研究表明,這些特化細胞中高水平的免疫抑制NBR1可能會識別出不太可能對免疫療法產生反應的患者。該研究還表明,在動物模型中,降低nbr1的策略有助于縮小腫瘤,這為那些對免疫治療無反應的患者提供了一種潛在的新治療方法。

圖1 NBR1和p62對肝星狀細胞STING通路的反向調節決定了肝細胞癌的進展
Jorge Moscat博士說:“P62和NBR1是陰陽。與NBR1相反,如果p62在肝星狀細胞中含量高,患者就不會患癌癥,但如果p62含量低,免疫系統就會被破壞。如果NBR1高,免疫系統就會受損,但如果NBR1低,免疫反應就會增強。”
直到最近,肝細胞癌患者幾乎沒有治療選擇,而那些可用的治療只能延長幾個月的生命。免疫療法為這些患者提供了一種新的選擇,并可能延長他們的生命長達兩年。
“肝臟是一個免疫功能受到極大抑制的器官,”聯合首席研究員Maria Diaz-Meco博士說。“重新激活免疫系統是一種非常有吸引力的方法,現在正在取得成果。”
然而,并非所有患者對免疫療法都有反應,只有一小部分患者實現了長期緩解。臨床醫生目前無法預測哪些患者會受益。她說:“我們需要生物標志物來確定哪些患者會有反應,哪些患者會獲得長期生存。”
Drs Moscat和Diaz-Meco與共同第一作者Sadaaki Nishimura博士和Juan F. Linares博士(分別是威爾康奈爾醫學院病理學和實驗室醫學系的博士后和講師)以及Antoine L'Hermitte博士(前Sanford Burnham Prebys醫學發現研究所)合作進行了這項研究。

圖2 p62通過促進HSC中第三方基序蛋白32(TRIM32)的STING泛素化來激活干擾素(IFN)級聯
研究人員旨在通過研究導致癌癥的肝臟愈合機制中出現的問題來確定生物標志物和潛在的治療靶點。先前的研究發現,在肝癌患者中,腫瘤抑制蛋白p62的水平不可逆轉地降低。這項新研究表明,通常情況下,p62通過激活一種叫做STING的蛋白質來促進免疫反應,這種蛋白質會將NBR1推開,引發一種破壞腫瘤細胞的免疫反應。相比之下,NBR1促進STING的分解并阻斷免疫反應。從肝細胞癌小鼠的肝星狀細胞中刪除NBR1,即使p62水平保持在低水平,也能恢復免疫反應并縮小腫瘤。
該團隊目前正在研究如何開發一種療法,使患者體內的NBR1降解,并阻止其與STING相互作用。目標是重新激活免疫系統,幫助提高免疫治療的有效性。激活STING的藥物也在開發中,可能會提供另一種方法來幫助增強肝細胞癌患者的免疫反應。該團隊還將研究敲除NBR1是否有助于防止多種癌癥的轉移或防止腫瘤對治療產生耐藥性。
Moscat和Diaz-Meco博士計劃繼續研究調節肝臟免疫反應的途徑。
“如果我們不能完全理解調節這些過程的分子機制,免疫療法就不會取得進展,我們也無法理解為什么它對一些病人有效,而對另一些病人無效,”Diaz-Meco博士說。
參考資料
[1] Opposing regulation of the STING pathway in hepatic stellate cells by NBR1 and p62 determines the progression of hepatocellular carcinoma



