2020 年初,新冠疫情肆虐全球,各國藥企均大力投入疫苗研發,希望及時研發出有效疫苗以阻止疫情擴散,這也讓原本還遠離大眾視線的 RNA 療法,廣為人知。
相比于傳統疫苗,RNA 疫苗仿佛是專門為新冠疫情準備的。美國疫苗生產企業 Moderna 在得到新冠病毒基因組序列后,僅用了 4 天,就獲得了新冠病毒刺突蛋白編碼片段,并合成相應 RNA,隨后將其封裝便可作為新冠疫苗。
RNA 疫苗被遞送至人體后,可在人體細胞內源源不斷的產生病毒蛋白,相當于將機體轉化為“疫苗工廠”,訓練免疫系統識別病毒入侵。然而,由于缺乏穩定、強大的 RNA 遞送平臺,RNA 疫苗的使用始終受限。
現在,RNA 疫苗使用的局限性有望被打破。
來自麻省理工學院的華人科學家張鋒教授帶領的研究團隊,成功開發了一種全新RNA遞送平臺——SEND。SEND 以人體內天然存在的 RNA 運輸蛋白 PEG 10 為基礎,通過對 PEG 10 蛋白進行改造就可以將不同的 RNA 運送到不同的細胞或器官。由于是天然存在于人體中的蛋白質,該平臺相較于其他 RNA 遞送方法可以有效避免機體的免疫攻擊。
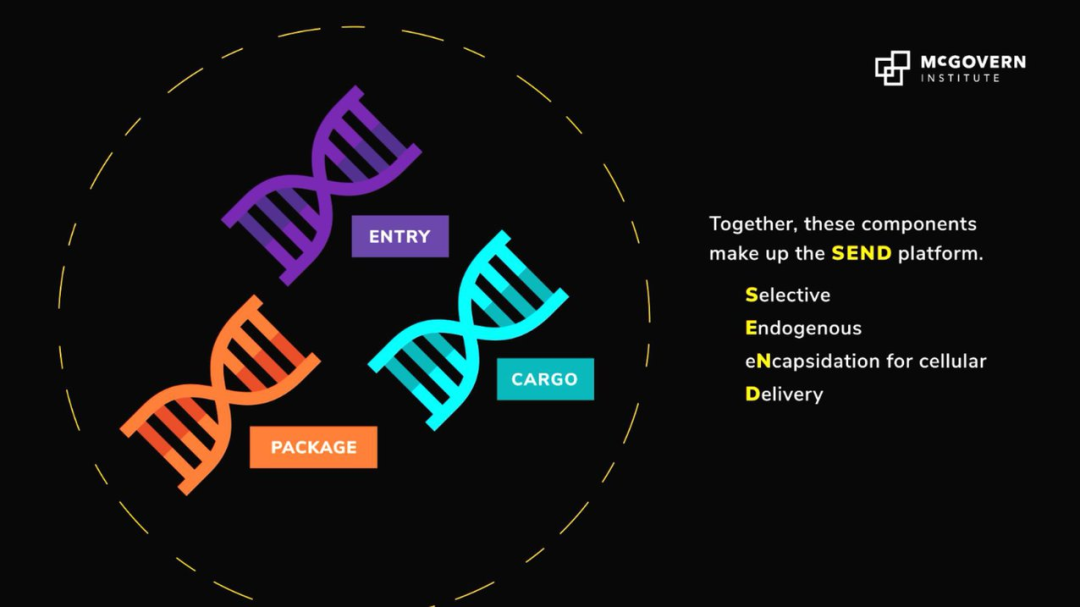
圖 | 全新的 RNA 遞送平臺 SEND(來源:MIT)
該研究以“Mammalian retrovirus-like protein PEG10 packages its own mRNA and can be pseudotyped for mRNA delivery”為題,發表在 Science 雜志上。
(來源:Science)
對于這一研究結果,CRISPR基因編輯技術的先驅者、Broad研究所核心研究成員、McGovern研究所研究員張鋒表示,“生物醫學界一直在開發強大的分子療法,但是如何將它們精確有效的傳遞給靶細胞,仍舊具有挑戰性。而 SEND 有望克服這些潛在的挑戰。”
一切蛋白質層面的疾病,都可以使用 RNA 療法解決
目前上市的小分子藥物,絕大部分的靶標都是蛋白質,這一策略在過去數十年來也帶來了大量好藥和新藥,據估計,接近 99%的口服藥物靶向的是致病蛋白。
但新藥研發人員對此卻并不滿足。首先,不少蛋白質無“可成藥性”,這意味著很難對其開發具有抑制性的小分子;其次,蛋白只占了基因組信息的極少部分。人類的基因組中,只有 1.5%的序列編碼了蛋白質,和疾病相關的蛋白更是只占其中的 10-15%。毫無疑問,如果小分子藥物的靶點能超越蛋白質,將給新藥研發帶來新的變革。

圖 | 因新冠疫情,mRNA 疫苗變得廣為人知(來源:Pixabay)
RNA 就是這樣一種潛在的靶點。在正常細胞中,RNA 有著重要的生理功能——mRNA 攜帶了基因的遺傳信息,指導蛋白質的合成;非編碼 RNA 則調控基因的表達。
靶向RNA也有著多種好處:由于處于蛋白質的上游,靶向 RNA 有望直接對蛋白質的翻譯效率進行上調或下調,解決蛋白“不可成藥”的難題;RNA 在人類基因組中極為豐富,產生非編碼 RNA 的序列更是占到了基因組的 70%,豐度比編碼蛋白質的序列高出一個數量級。
然而在既往的幾十年間,由于 RNA 分子容易降解,在體內半衰期很短,一直被認為無法成為“治療藥物”。
直到近年來,隨著技術進步以及穩定性化學的改進,半衰期較短的 RNA 分子反而成為了臨床新寵,逐漸吸引了業界的注意,進入爆發增長階段。
作為一種新型療法,RNA 藥物的研發周期短、生產工藝簡單、成本低、效果強、產能擴張迅速、安全性更好,這是其天然的優勢。例如,疫情期間,新冠病毒 RNA 疫苗的研發在得到病毒基因序列后數天之內就完成了,其療效也得到了真實世界數據的驗證。
目前,RNA 療法的應用前景十分廣闊,包括疫苗、腫瘤免疫治療、單抗藥物替代、蛋白藥物替代、輔助生殖等等。理論上,一切蛋白質層面的疾病都可以通過 RNA 療法治療。
RNA藥物的障礙:遞送
雖然 RNA 藥物的應用前景非常廣闊,但是目前 RNA 藥物的研發也面臨著一個巨大的挑戰,那就是 RNA 遞送的問題。
核酸藥物想要進入體內,主要有以下3個難關:核酸的分子量和負電荷使其不能自由通過生物膜;RNA 容易被血漿和組織中 RNase 酶降解,被肝臟和腎臟快速清除和被免疫系統識別;進入細胞后 “卡” 在內吞小體中無法發揮功能。
以上幾點讓 RNA 藥物發展面臨的技術障礙——藥物遞送,一直沒有得到解決。目前,解決遞送問題主要有兩個方法:一個是改造核酸分子,讓其穩定并躲避免疫系統的識別;另外一個就是利用藥物傳輸系統,比如說脂質納米顆粒(LNP)和載體病毒。
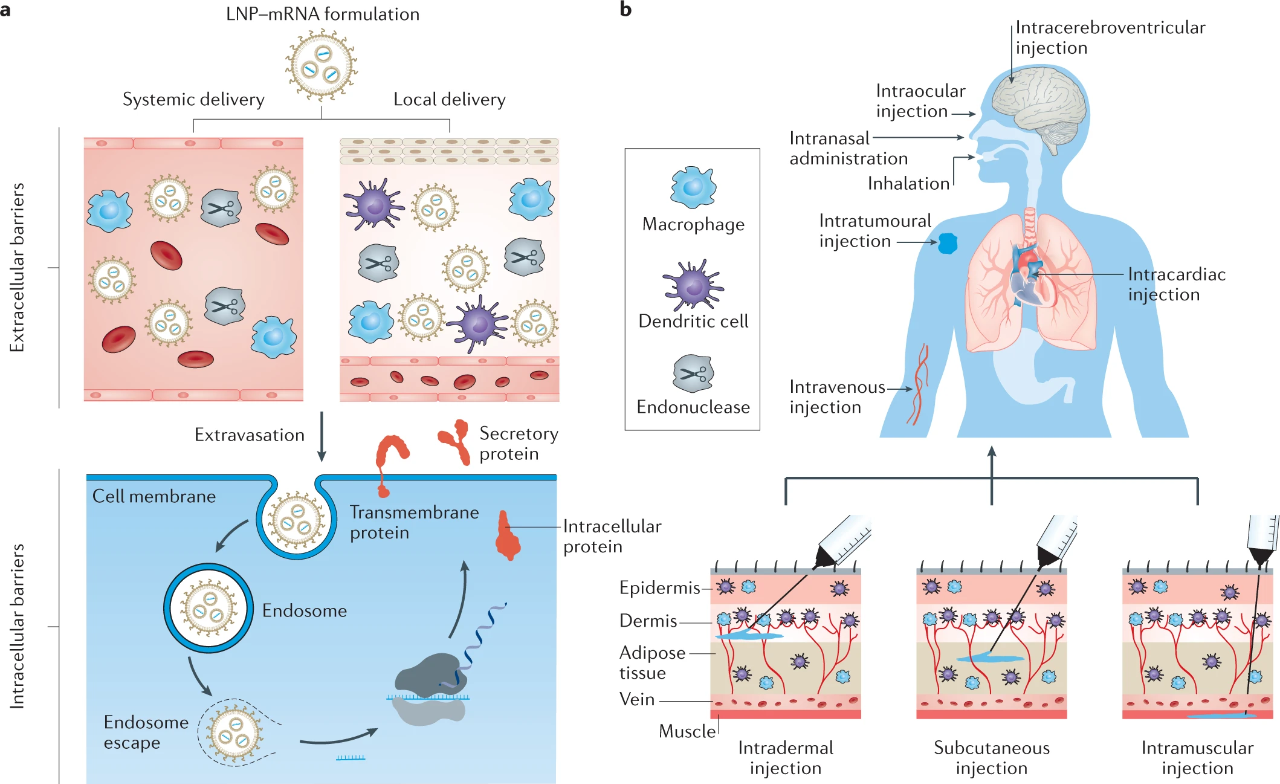
圖 | mRNA 藥物的脂質納米顆粒遞送途徑(來源:Nature)
納米脂質體遞送 RNA 的原理目前還不清楚,但是通常認為,納米脂質體通過非共價親和力和細胞膜結合并通過內吞作用被攝取,進入細胞后 RNA 逃離內吞小泡,被釋放到細胞質中表達靶蛋白。納米脂質體還可以通過相反的胞吐作用被排出細胞外,這也是通過納米脂質體進行 RNA 給藥需要注意的點。
目前 RNA 還是主要依靠納米制劑遞送,而由于納米脂質體的限制,所以目前RNA療法僅適合肝臟、脾臟靶向治療,其他組織難以靶向。同時,mRNA 藥物過膜性低也導致出現懸殊的個體差異,如果藥物過膜性是 1%,那么 1% 的個體差異會導致兩倍有效藥物濃度差異,但如果過膜性是 50%,那么 1% 的個體差異則無關緊要。
現在業界的策略是,首先選擇疫苗這樣安全窗口較大的項目,但如果擴大到更復雜靶點,業界需要找到可監測藥物應答的生物標記。
打破RNA治療困境
PEG 10 蛋白天然存在于人體內,源自一種類似病毒的遺傳元件——“逆轉錄轉座子”。PEG 10 蛋白在數百萬年前被整合進人類祖先的基因組中,隨著時間的推移,PEG 10 已與人類基因組融為一體,在人體內發揮重要的功能。
此前,研究人員發現,另一種逆轉錄轉座子衍生蛋白 ARC 可以形成病毒樣結構,并參與細胞間 RNA 的轉移。這一研究結果表明,逆轉錄轉座子相關蛋白或許可以作為 RNA 遞送平臺用于 RNA 療法,但是此前科學家尚未成功利用 ARC 蛋白在哺乳動物細胞中運送 RNA。
為了進一步探索逆轉錄轉座子蛋白的功能,張鋒教授帶領研究團隊對人類基因組中的逆轉錄轉座子蛋白進行了系統的搜索,尋找潛在可以運輸 RNA 的蛋白質。
初步分析顯示,人類基因組中有 48 個基因可能編碼了逆轉錄轉座子蛋白。其中,有 19 中蛋白質同時存在于小鼠和人類中。
在體外研究中,研究人員發現,逆轉錄轉座子蛋白 PEG 10 是一種高效的 RNA 載體蛋白。相比于其他逆轉錄轉座子蛋白,PEG 10 在哺乳動物細胞內穿透性更強,且本身就參與 RNA 運輸。
隨后研究人員在 PEG 10 蛋白的 mRNA 中找到了識別和包裝 RNA 的分子序列。通過對 FEG 10 蛋白 mRNA 分子包裝序列,以及 PEG 10 蛋白進行修飾,研究人員試圖讓 PEG 10 蛋白搭載不同的 RNA,并靶向不同的細胞。
研究人員開發了兩種不同蛋白修飾的 PEG 10 蛋白,并在細胞試驗中實現靶細胞 RNA 遞送。
對此,張鋒教授表示,“我們的研究表明,通過對 PEG 10 蛋白的 RNA 包裝組件和識別組件進行改造,理論上就可以針對不同的疾病治療提供一個模塊化的平臺。”
由于 SEND 平臺所用的 RNA 載體均來源于體內天然蛋白自,這意味著這一系統不會觸發機體免疫反應,副作用大大降低。未來,SEND 技術或將替代納米脂質體和病毒載體,成為適合基因編輯療法的載體。
下一步,該團隊將會在動物體內測試 SEND,并進一步設計和開發更多的逆轉錄轉座子蛋白,以便將更多的 RNA 遞送至各個組織和細胞。



