哺乳動(dòng)物和微生物之間的相互作用對(duì)癌癥產(chǎn)生了深遠(yuǎn)的影響。據(jù)報(bào)道,幾種慢性感染與癌癥的發(fā)展直接相關(guān),它們與癌癥的一個(gè)重要聯(lián)系是微生物群調(diào)節(jié)免疫系統(tǒng)和促進(jìn)慢性炎癥的能力。有證據(jù)表明,微生物群也會(huì)影響腫瘤對(duì)治療的反應(yīng),包括對(duì)免疫檢查點(diǎn)封鎖治療的反應(yīng)。
先天淋巴細(xì)胞 (ILC) 是近期廣受重視的一種組織駐留先天淋巴細(xì)胞,在調(diào)節(jié)哺乳動(dòng)物身體粘膜屏障表面的宿主-微生物相互作用方面發(fā)揮著關(guān)鍵作用。有研究稱,ILC3s可浸潤腫瘤,并通過細(xì)胞因子的產(chǎn)生影響癌癥的發(fā)生與發(fā)展。那么,ILC3s和適應(yīng)性免疫之間的相互作用在癌癥中是否也很重要呢?
2021年8月17日國際學(xué)術(shù)期刊《Cell》在線發(fā)表了美國康奈爾大學(xué)Gregory F. Sonnenberg課題組名為“Dysregulation of ILC3s unleashes progression and immunotherapy resistance in colon cancer”的研究。該研究發(fā)現(xiàn):ILC3的失調(diào)促進(jìn)結(jié)腸癌的進(jìn)展和免疫療法的抗性。

研究人員收集了72位患者的結(jié)直腸癌及鄰近組織標(biāo)本,全面分析其臨床及病理數(shù)據(jù),發(fā)現(xiàn)結(jié)直腸癌中CD45+細(xì)胞中ILC3s顯著降低,同時(shí)在自發(fā)性結(jié)腸癌小鼠模型得出了相同結(jié)果。隨后,研究人員將ILC3s分類純化進(jìn)行RNA-seq,發(fā)現(xiàn)NKp46+ ILC3s顯著下降、CCR6+ ILC3s顯著增加,對(duì)ILC1s或ex-ILC3s的可塑性增加。
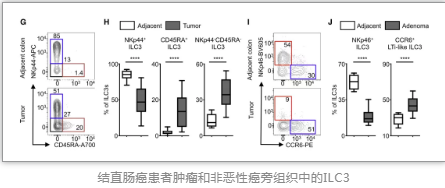
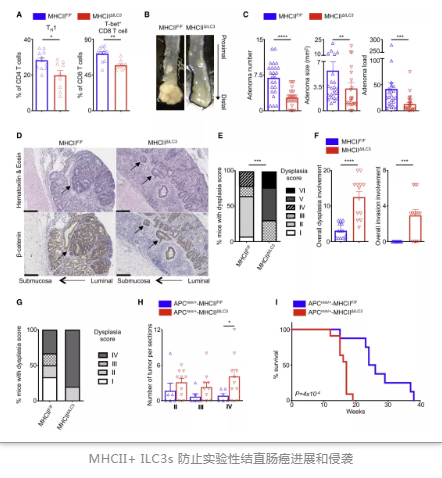
隨后,研究人員對(duì)結(jié)直腸癌中ILC3s和適應(yīng)性免疫之間的相互作用進(jìn)行深入研究,并觀察到在患者及模型小鼠腫瘤中TH17增加,TH1細(xì)胞減少。同時(shí),其腸道微生物群與對(duì)照組相比具有明顯不同,與IBD患者腸道微生物群類似。值得注意的是,在模型鼠中,ilc3特異性MHCII的缺失導(dǎo)致體重增加,脾臟重量增加,結(jié)腸長度減少。因此,研究人員認(rèn)為,MHCII+ ILC3s和T細(xì)胞之間的相互作用對(duì)于在癌癥中的I型免疫反應(yīng)具有重要作用。
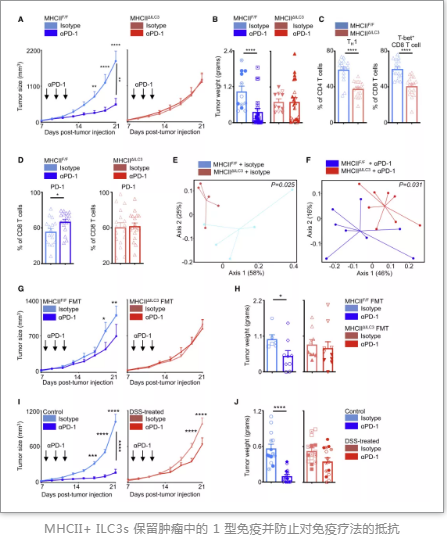
另一方面,研究人員將 MC38 結(jié)腸腫瘤細(xì)胞系皮下植入同窩對(duì)照小鼠和MHCIIDILC3小鼠中,并應(yīng)用PD-1單抗對(duì)兩組小鼠進(jìn)行治療。在對(duì)照組中,腫瘤得到了強(qiáng)有力的控制,而MHCIIDILC3小鼠則表現(xiàn)出了顯著的耐藥性。因此,研究人員認(rèn)為ILC3和T細(xì)胞之間通過II類主要組織相容性復(fù)合體(MHCII)相互聯(lián)系,ILC3減少引發(fā)了炎癥和微生物群變化,從而驅(qū)動(dòng)了對(duì)檢查點(diǎn)封鎖療法的抵抗。
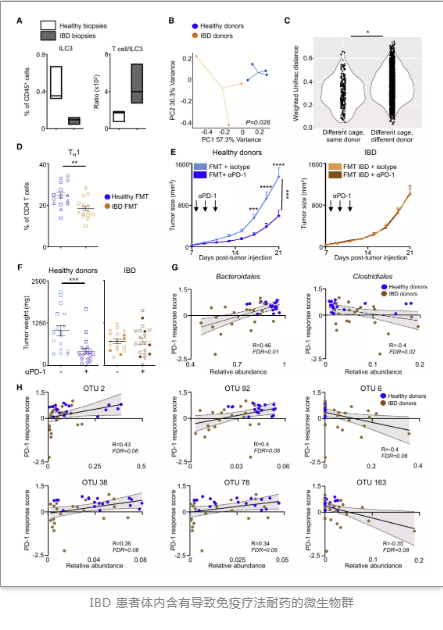
研究人員假設(shè)IBD患者的微生物群對(duì)I型免疫無促進(jìn)作用,且會(huì)阻礙免疫治療。與健康人群相比,活動(dòng)性IBD患者的結(jié)腸直腸活檢中ILC3s減少,T 細(xì)胞/ILC3 比率增加。通過將健康人群及IBD患者腸道菌群定植(FMT)于小鼠腸道中,研究人員觀察到,患有腸道ILC3失調(diào)的人類攜帶的微生物群定植到小鼠身上不能誘導(dǎo)1型免疫、提高對(duì)免疫療法的反應(yīng)性。
總的來說,這些數(shù)據(jù)確定了ILC3在癌癥中的保護(hù)作用,并表明它們?cè)贑RC中的固有干擾會(huì)導(dǎo)致適應(yīng)性免疫功能失調(diào)、腫瘤進(jìn)展和免疫療法的抗性。這些發(fā)現(xiàn)對(duì)IBD患者的治療和免疫檢查點(diǎn)封鎖療法在胃腸道癌癥中的應(yīng)用都具有重要意義,對(duì)我們理解多種癌癥類型中的ILC3和宿主-微生物相互作用也有廣泛意義,將來也許可以通過這些途徑改進(jìn)癌癥治療靶點(diǎn)及療效。



