摘要:研究人員圍繞 AD 患者來源的高分子量 tau 對海馬神經(jīng)元的影響展開研究。
在阿爾茨海默病(Alzheimer’s disease,AD)的神秘世界里,大腦中的 β - 淀粉樣蛋白(Aβ)斑塊和 tau 神經(jīng)原纖維纏結(jié)(NFTs)一直是研究的焦點。然而,tau 病理的負擔、空間分布和區(qū)域特異性與疾病相關(guān)的認知障礙最為密切相關(guān)。近年來,越來越多的證據(jù)表明,可溶性 tau,而非纏結(jié),與患者的臨床進展速率最為相關(guān)。在小鼠模型中,抑制可溶性 tau 的干預(yù)措施能夠恢復(fù)網(wǎng)絡(luò)和記憶功能。盡管如此,可溶性 tau 損害神經(jīng)元功能的潛在機制仍然是個謎。
記憶的形成和存儲與海馬體密切相關(guān),海馬體中的神經(jīng)元就像一個個 “信息處理器”,它們通過特殊的方式傳遞和處理信息。其中,海馬錐體細胞不僅能通過單個動作電位(spikes)傳遞信息,還能以復(fù)雜的爆發(fā)式放電(burst firing)模式進行信息交流。爆發(fā)式放電在增強信息傳遞可靠性、提高信息內(nèi)容、促進與活動相關(guān)的突觸可塑性等方面發(fā)揮著關(guān)鍵作用,對記憶引導(dǎo)的行為至關(guān)重要。例如,學(xué)習能夠增強大腦皮層和海馬體中的爆發(fā)式放電,而且這種放電模式對于基于海馬體的學(xué)習任務(wù)來說是必不可少的。在網(wǎng)絡(luò)層面,海馬體中的神經(jīng)元爆發(fā)式放電在空間導(dǎo)航和記憶過程中支持 theta 節(jié)律計算,也是神經(jīng)元離線重放(offline neuronal replay)的一個重要特征,這對于記憶鞏固和其他認知操作(如決策和推理)至關(guān)重要。
 圖1 阿爾茨海默病tau蛋白損害海馬神經(jīng)元
圖1 阿爾茨海默病tau蛋白損害海馬神經(jīng)元為了揭開 AD 相關(guān)病理,尤其是特定種類的可溶性人類 tau,對海馬體 CA1 區(qū)神經(jīng)元爆發(fā)式放電的影響這一謎題,來自英國倫敦大學(xué)學(xué)院(University College London)、美國哈佛醫(yī)學(xué)院(Harvard Medical School)等多個研究機構(gòu)的研究人員展開了深入研究。他們的研究成果發(fā)表在《Cell》雜志上,為我們理解 AD 的發(fā)病機制帶來了新的曙光。
研究人員運用了多種關(guān)鍵技術(shù)方法。在動物實驗方面,他們使用了 AD 小鼠模型,包括 APP/PS1-rTg4510、APP/PS1、rTg4510 和 PS19 小鼠等,并對這些小鼠進行體內(nèi) Neuropixels 記錄和膜片鉗記錄。在人類樣本研究中,他們獲取了 AD 患者和健康對照的人類大腦組織,從 AD 患者大腦中分離出高分子量 tau(HMW tau),并在野生型小鼠的海馬切片上進行全細胞膜片鉗記錄。同時,他們還運用了免疫組化分析、蛋白質(zhì)印跡(Western blot)等技術(shù)來檢測相關(guān)蛋白的表達和含量。
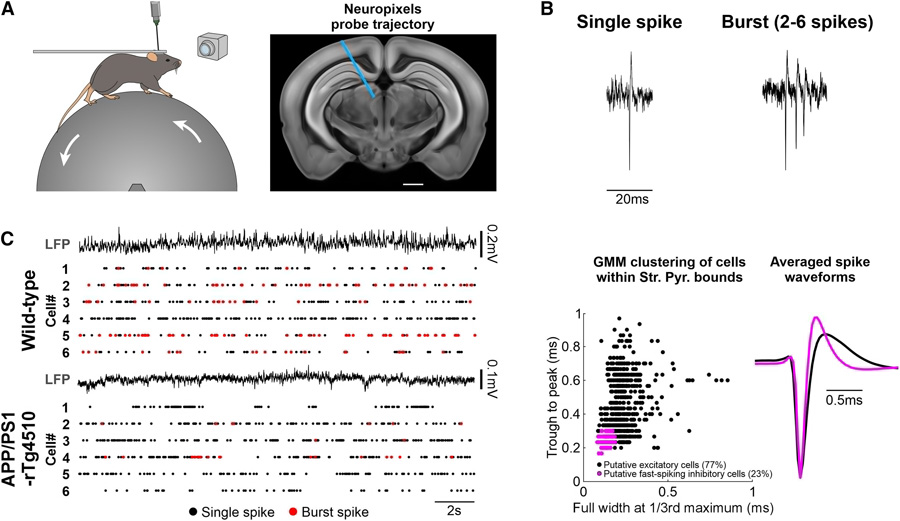
圖2 在同時表達β淀粉樣蛋白(Aβ)和tau病理的APP/PS1-rTg4510小鼠模型中存在簇狀放電受抑制現(xiàn)象
研究結(jié)果如下:
AD 病理損害海馬神經(jīng)元的爆發(fā)式放電:研究人員通過對 9 個月大的 APP/PS1-rTg4510 小鼠(同時積累 Aβ 和 tau 病理)和野生型(WT)小鼠進行體內(nèi) Neuropixels 記錄,發(fā)現(xiàn) APP/PS1-rTg4510 小鼠海馬 CA1 區(qū)神經(jīng)元的爆發(fā)式放電顯著減少。具體表現(xiàn)為,APP/PS1-rTg4510 小鼠神經(jīng)元的峰間間隔(ISI)分布中,2 - 6ms 的爆發(fā)內(nèi) ISI 峰值消失,爆發(fā)指數(shù)(burst index)顯著降低。而且,這種小鼠的靜息態(tài)神經(jīng)元放電率也降低,且主要是由于爆發(fā)式放電的減少,而非單個動作電位放電的變化。此外,APP/PS1-rTg4510 小鼠高頻振蕩波紋(ripple)事件的發(fā)生率顯著降低,對 ripple 事件的爆發(fā)式放電反應(yīng)也明顯受到抑制。
CA1 神經(jīng)元的爆發(fā)式放電受損與 tau 相關(guān):通過比較 APP/PS1(僅 Aβ 病理)、rTg4510(僅 tau 病理)、APP/PS1-rTg4510 小鼠和 WT 小鼠的神經(jīng)元放電情況,發(fā)現(xiàn) rTg4510 小鼠神經(jīng)元的放電模式與 APP/PS1-rTg4510 小鼠相似,都存在爆發(fā)式放電減少的現(xiàn)象,而 APP/PS1 小鼠神經(jīng)元的爆發(fā)式放電則有所增加。這表明 tau 病理是導(dǎo)致 CA1 神經(jīng)元爆發(fā)式放電受損的主要原因。進一步研究發(fā)現(xiàn),tau 病理還會導(dǎo)致神經(jīng)元放電與網(wǎng)絡(luò)振蕩活動的同步性受損,theta - PLV 峰值幅度和 theta - gamma 耦合顯著降低,且這些指標與爆發(fā)指數(shù)呈正相關(guān)。
爆發(fā)式放電受損與 CaV2.3 鈣通道表達減少有關(guān):對 2 - 3 個月大的 rTg4510 小鼠(此時可溶性 tau 水平升高,但 tau 纏結(jié)不明顯)進行體內(nèi)全細胞膜片鉗記錄,發(fā)現(xiàn)其海馬 CA1 錐體神經(jīng)元的爆發(fā)式放電減少。免疫組化分析顯示,rTg4510 小鼠神經(jīng)元中 CaV2.3 鈣通道的表達顯著降低,而 NMDA 受體亞基 NR1 的表達在此時沒有明顯差異。通過給予 rTg4510 小鼠多西環(huán)素(Dox)抑制可溶性 tau 的產(chǎn)生,發(fā)現(xiàn) CaV2.3 鈣通道的表達增加,且 HMW tau 水平降低與更快、更復(fù)雜的爆發(fā)式放電事件的概率增加相關(guān)。
AD 患者來源的 HMW tau 抑制海馬神經(jīng)元的爆發(fā)式放電:從 AD 患者大腦中分離出 HMW tau,并將其添加到野生型小鼠海馬切片的 CA1 錐體神經(jīng)元的記錄電極內(nèi)。結(jié)果發(fā)現(xiàn),10nM 的 HMW tau 能夠顯著減少神經(jīng)元的爆發(fā)式放電事件,但對單個動作電位沒有影響。而低分子量(LMW)tau、免疫耗盡 tau 的組分以及重組 tau 都沒有這種抑制作用。
研究結(jié)論和討論部分指出,該研究揭示了人類 tau 在單神經(jīng)元水平上的病理生理影響,即抑制海馬 CA1 區(qū)的復(fù)雜爆發(fā)式放電,這是記憶引導(dǎo)認知的關(guān)鍵細胞機制。tau 導(dǎo)致的爆發(fā)式放電受損會損害與這種放電模式密切相關(guān)的電路機制,其機制與 CaV2.3 通道的顯著下調(diào)有關(guān),而 tau 抑制可以改善這種下調(diào)。研究還確定了可溶性 HMW tau 是導(dǎo)致海馬神經(jīng)元爆發(fā)式放電能力顯著降低的主要原因,無論是在小鼠模型還是從 AD 患者大腦中分離出的 HMW tau 都有這種作用。這一發(fā)現(xiàn)為解釋 HMW tau 與 AD 臨床進展速率密切相關(guān)提供了細胞層面的解釋,也為 AD 的治療提供了潛在的新靶點,即降低細胞內(nèi) HMW tau 水平或恢復(fù)神經(jīng)元的爆發(fā)式放電,如通過調(diào)節(jié) CaV2.3 通道。不過,該研究也存在一定的局限性,如體外膜片鉗實驗僅使用了一位 AD 患者的大腦提取物,HMW tau 調(diào)節(jié) CaV2.3 表達的具體機制尚未研究等,未來還需要進一步深入探索。
參考資料
[1]Alzheimer’s disease patient-derived high-molecular-weight tau impairs bursting in hippocampal neurons
摘要:研究人員圍繞 AD 患者來源的高分子量 tau 對海馬神經(jīng)元的影響展開研究。
在阿爾茨海默病(Alzheimer’s disease,AD)的神秘世界里,大腦中的 β - 淀粉樣蛋白(Aβ)斑塊和 tau 神經(jīng)原纖維纏結(jié)(NFTs)一直是研究的焦點。然而,tau 病理的負擔、空間分布和區(qū)域特異性與疾病相關(guān)的認知障礙最為密切相關(guān)。近年來,越來越多的證據(jù)表明,可溶性 tau,而非纏結(jié),與患者的臨床進展速率最為相關(guān)。在小鼠模型中,抑制可溶性 tau 的干預(yù)措施能夠恢復(fù)網(wǎng)絡(luò)和記憶功能。盡管如此,可溶性 tau 損害神經(jīng)元功能的潛在機制仍然是個謎。
記憶的形成和存儲與海馬體密切相關(guān),海馬體中的神經(jīng)元就像一個個 “信息處理器”,它們通過特殊的方式傳遞和處理信息。其中,海馬錐體細胞不僅能通過單個動作電位(spikes)傳遞信息,還能以復(fù)雜的爆發(fā)式放電(burst firing)模式進行信息交流。爆發(fā)式放電在增強信息傳遞可靠性、提高信息內(nèi)容、促進與活動相關(guān)的突觸可塑性等方面發(fā)揮著關(guān)鍵作用,對記憶引導(dǎo)的行為至關(guān)重要。例如,學(xué)習能夠增強大腦皮層和海馬體中的爆發(fā)式放電,而且這種放電模式對于基于海馬體的學(xué)習任務(wù)來說是必不可少的。在網(wǎng)絡(luò)層面,海馬體中的神經(jīng)元爆發(fā)式放電在空間導(dǎo)航和記憶過程中支持 theta 節(jié)律計算,也是神經(jīng)元離線重放(offline neuronal replay)的一個重要特征,這對于記憶鞏固和其他認知操作(如決策和推理)至關(guān)重要。
 圖1 阿爾茨海默病tau蛋白損害海馬神經(jīng)元
圖1 阿爾茨海默病tau蛋白損害海馬神經(jīng)元為了揭開 AD 相關(guān)病理,尤其是特定種類的可溶性人類 tau,對海馬體 CA1 區(qū)神經(jīng)元爆發(fā)式放電的影響這一謎題,來自英國倫敦大學(xué)學(xué)院(University College London)、美國哈佛醫(yī)學(xué)院(Harvard Medical School)等多個研究機構(gòu)的研究人員展開了深入研究。他們的研究成果發(fā)表在《Cell》雜志上,為我們理解 AD 的發(fā)病機制帶來了新的曙光。
研究人員運用了多種關(guān)鍵技術(shù)方法。在動物實驗方面,他們使用了 AD 小鼠模型,包括 APP/PS1-rTg4510、APP/PS1、rTg4510 和 PS19 小鼠等,并對這些小鼠進行體內(nèi) Neuropixels 記錄和膜片鉗記錄。在人類樣本研究中,他們獲取了 AD 患者和健康對照的人類大腦組織,從 AD 患者大腦中分離出高分子量 tau(HMW tau),并在野生型小鼠的海馬切片上進行全細胞膜片鉗記錄。同時,他們還運用了免疫組化分析、蛋白質(zhì)印跡(Western blot)等技術(shù)來檢測相關(guān)蛋白的表達和含量。

圖2 在同時表達β淀粉樣蛋白(Aβ)和tau病理的APP/PS1-rTg4510小鼠模型中存在簇狀放電受抑制現(xiàn)象
研究結(jié)果如下:
AD 病理損害海馬神經(jīng)元的爆發(fā)式放電:研究人員通過對 9 個月大的 APP/PS1-rTg4510 小鼠(同時積累 Aβ 和 tau 病理)和野生型(WT)小鼠進行體內(nèi) Neuropixels 記錄,發(fā)現(xiàn) APP/PS1-rTg4510 小鼠海馬 CA1 區(qū)神經(jīng)元的爆發(fā)式放電顯著減少。具體表現(xiàn)為,APP/PS1-rTg4510 小鼠神經(jīng)元的峰間間隔(ISI)分布中,2 - 6ms 的爆發(fā)內(nèi) ISI 峰值消失,爆發(fā)指數(shù)(burst index)顯著降低。而且,這種小鼠的靜息態(tài)神經(jīng)元放電率也降低,且主要是由于爆發(fā)式放電的減少,而非單個動作電位放電的變化。此外,APP/PS1-rTg4510 小鼠高頻振蕩波紋(ripple)事件的發(fā)生率顯著降低,對 ripple 事件的爆發(fā)式放電反應(yīng)也明顯受到抑制。
CA1 神經(jīng)元的爆發(fā)式放電受損與 tau 相關(guān):通過比較 APP/PS1(僅 Aβ 病理)、rTg4510(僅 tau 病理)、APP/PS1-rTg4510 小鼠和 WT 小鼠的神經(jīng)元放電情況,發(fā)現(xiàn) rTg4510 小鼠神經(jīng)元的放電模式與 APP/PS1-rTg4510 小鼠相似,都存在爆發(fā)式放電減少的現(xiàn)象,而 APP/PS1 小鼠神經(jīng)元的爆發(fā)式放電則有所增加。這表明 tau 病理是導(dǎo)致 CA1 神經(jīng)元爆發(fā)式放電受損的主要原因。進一步研究發(fā)現(xiàn),tau 病理還會導(dǎo)致神經(jīng)元放電與網(wǎng)絡(luò)振蕩活動的同步性受損,theta - PLV 峰值幅度和 theta - gamma 耦合顯著降低,且這些指標與爆發(fā)指數(shù)呈正相關(guān)。
爆發(fā)式放電受損與 CaV2.3 鈣通道表達減少有關(guān):對 2 - 3 個月大的 rTg4510 小鼠(此時可溶性 tau 水平升高,但 tau 纏結(jié)不明顯)進行體內(nèi)全細胞膜片鉗記錄,發(fā)現(xiàn)其海馬 CA1 錐體神經(jīng)元的爆發(fā)式放電減少。免疫組化分析顯示,rTg4510 小鼠神經(jīng)元中 CaV2.3 鈣通道的表達顯著降低,而 NMDA 受體亞基 NR1 的表達在此時沒有明顯差異。通過給予 rTg4510 小鼠多西環(huán)素(Dox)抑制可溶性 tau 的產(chǎn)生,發(fā)現(xiàn) CaV2.3 鈣通道的表達增加,且 HMW tau 水平降低與更快、更復(fù)雜的爆發(fā)式放電事件的概率增加相關(guān)。
AD 患者來源的 HMW tau 抑制海馬神經(jīng)元的爆發(fā)式放電:從 AD 患者大腦中分離出 HMW tau,并將其添加到野生型小鼠海馬切片的 CA1 錐體神經(jīng)元的記錄電極內(nèi)。結(jié)果發(fā)現(xiàn),10nM 的 HMW tau 能夠顯著減少神經(jīng)元的爆發(fā)式放電事件,但對單個動作電位沒有影響。而低分子量(LMW)tau、免疫耗盡 tau 的組分以及重組 tau 都沒有這種抑制作用。
研究結(jié)論和討論部分指出,該研究揭示了人類 tau 在單神經(jīng)元水平上的病理生理影響,即抑制海馬 CA1 區(qū)的復(fù)雜爆發(fā)式放電,這是記憶引導(dǎo)認知的關(guān)鍵細胞機制。tau 導(dǎo)致的爆發(fā)式放電受損會損害與這種放電模式密切相關(guān)的電路機制,其機制與 CaV2.3 通道的顯著下調(diào)有關(guān),而 tau 抑制可以改善這種下調(diào)。研究還確定了可溶性 HMW tau 是導(dǎo)致海馬神經(jīng)元爆發(fā)式放電能力顯著降低的主要原因,無論是在小鼠模型還是從 AD 患者大腦中分離出的 HMW tau 都有這種作用。這一發(fā)現(xiàn)為解釋 HMW tau 與 AD 臨床進展速率密切相關(guān)提供了細胞層面的解釋,也為 AD 的治療提供了潛在的新靶點,即降低細胞內(nèi) HMW tau 水平或恢復(fù)神經(jīng)元的爆發(fā)式放電,如通過調(diào)節(jié) CaV2.3 通道。不過,該研究也存在一定的局限性,如體外膜片鉗實驗僅使用了一位 AD 患者的大腦提取物,HMW tau 調(diào)節(jié) CaV2.3 表達的具體機制尚未研究等,未來還需要進一步深入探索。
參考資料
[1]Alzheimer’s disease patient-derived high-molecular-weight tau impairs bursting in hippocampal neurons



