眾所周知,在血液循環中,紅細胞主要負責向身體各個器官和組織輸送氧氣,好像一個安靜低調的搬運工。然而,近期的研究發現紅細胞比我們想象的要重要得多。
美國賓夕法尼亞大學研究團隊在《Science Translational Medicine》發表論文:“DNA binding to TLR9 expressed by red bloodcells promotes innate immune activation and anemia”,揭開了紅細胞的“新身份”。
研究發現,紅細胞(red blood cells,RBC)不僅僅是氧氣搬運工,還承擔著偵察兵的角色,它是免疫系統中的重要一環,其膜表面可以表達TLR9蛋白,并能夠在體外與細菌、瘧原蟲和線粒體的 CpG-DNA 結合,加速紅細胞吞噬作用和先天免疫激活,促進炎癥細胞因子分泌、免疫細胞成熟和增殖,從而在病理狀態下起到免疫哨兵的作用,這一發現揭示了紅細胞作為氧氣運輸功能關鍵參與者之外未被重視的另一功能。
在呼吸系統中,紅細胞接受來自肺部的氧氣運動到身體的各個組織,這也讓它有更大的幾率接觸到病原體或者抗原。研究人員在膿毒癥患者與新冠肺炎患者的血液中對紅細胞進行了研究,結果發現,在膿毒癥期間,紅細胞表面TLR9增加,同時,表達TLR9的紅細胞可以結合內線粒體的CPG-DNA。在炎癥狀態下,這種現象可以加速身體的免疫進程。
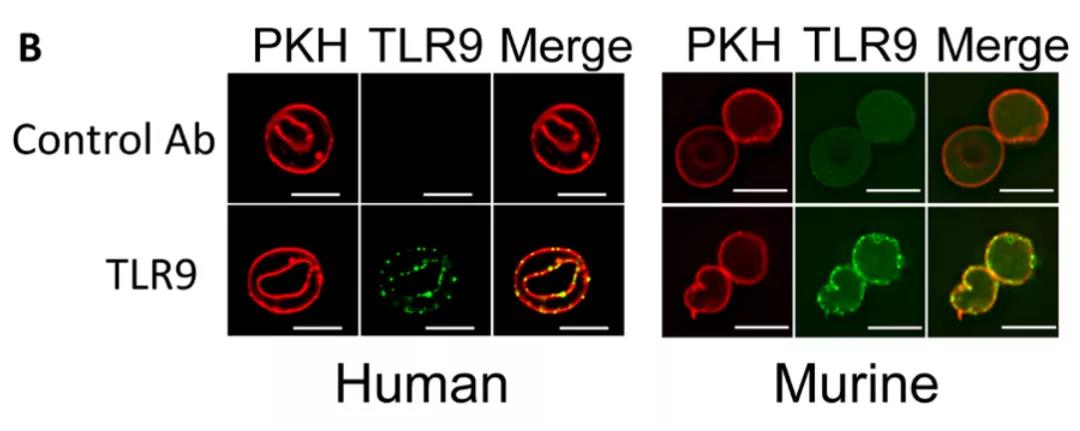
那么,TLR9紅細胞與CPG-DNA的結合,是否會使紅細胞的結構與功能產生變化呢?研究顯示,在無菌炎癥和感染期間,血漿中含有CPG的游離DNA升高,研究者們用CpG-DNA直接處理紅細胞,并用電子顯微鏡直接觀察到了紅細胞外形結構的變化:與CPG結合的紅細胞明顯發生了變形,細胞膜發生皺縮。為進行進一步確認,研究人員采用流式細胞術檢查了CpG紅細胞孵育后的形態,該分析顯示,與 CpG 結合的紅細胞確實具有異常形態。
除了形態,紅細胞的功能也發生了一定變化,研究人員采用逐量添加CpG-DNA的方式,觀察其對紅細胞功能的影響,分析結果顯示,CpG-DNA的添加導致紅細胞的滲透脆性降低,而滲透脆性降低的紅細胞,將極易誘發炎癥病人貧血的發生 。

隨后,研究人員發現,與CpG結合的紅細胞會導致CD47蛋白的缺失,而CD47蛋白的缺失會加速紅髓 F4/80 陽性脾巨噬細胞 (RPM)的吞噬作用。當紅細胞結合CpG-DNA之后,將導致免疫系統通過巨噬細胞加速清除體內的壞死細胞、病原體等以保護機體不受傷害。當研究人員用PBS(空白組)和CpG DNA(實驗組)處理紅細胞2小時,并將其注入小鼠體內,他們發現輸注1小時后小鼠體內的巨噬細胞開始攝入紅細胞。與空白組相比,實驗組顯示更多的紅細胞被巨噬細胞吞噬,20小時后脾臟更加嚴重,這一現象與紅細胞吞噬增多導致的脾充血的現象吻合。而這些發現表明,紅細胞結合CpG-DNA導致體內紅細胞被吞噬的進程加速,巨噬細胞清除結合CPG-DNA的紅細胞將激活機體的先天免疫。
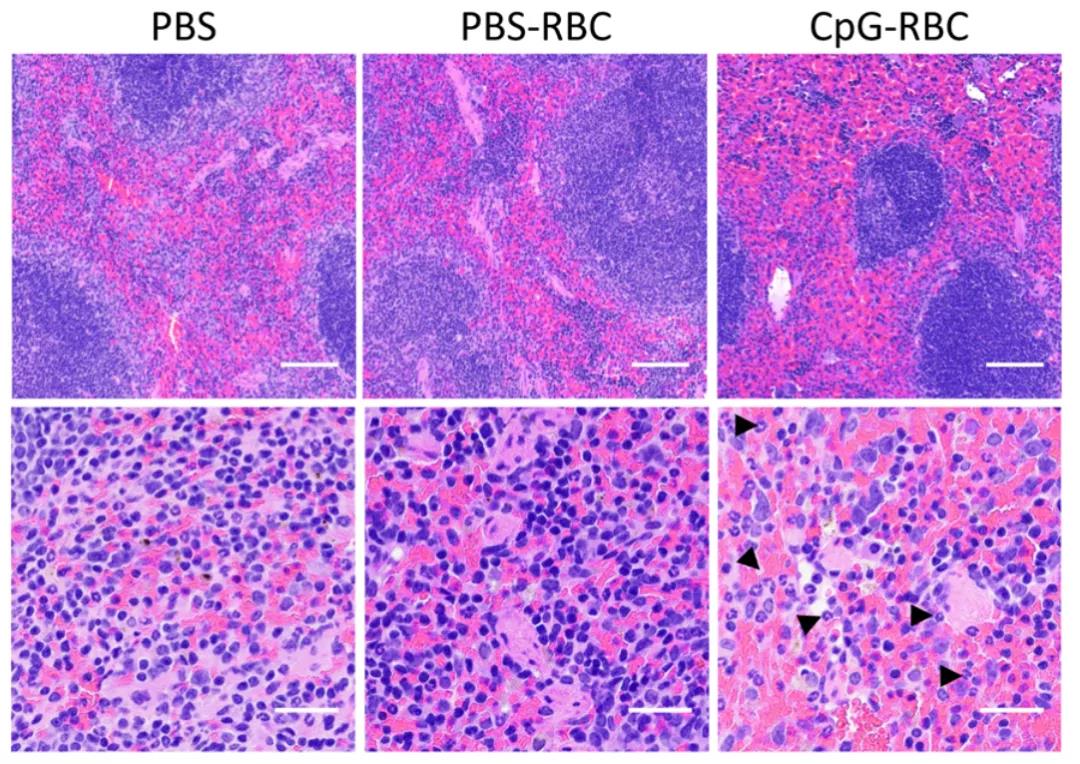
總之,在這項研究中,研究者們確定了紅細胞在免疫應答感染中的新作用。多種感染性和非感染性炎癥性疾病的貧血發病機制可能就是因為血漿中過量的CpG-DNA導致紅細胞的清除和破壞,從而導致炎癥患者產生了嚴重的貧血病癥。而這項研究成果與先前發現的血小板在先天和適應性免疫中的作用相結合,可以真正的了解血管腔內的先天免疫,具有巨大的疫苗開發和免疫治療方法的潛力。



