心臟是生命的發動機,源源不斷地提供循環系統中的動力,是生物體內關鍵的和精密的器官之一。在心臟內部,心房與心室之間有瓣膜,這些瓣膜使血液只能由心房流入心室而不能倒流。如此精密的結構是如何形成的呢?近日,法國健康與醫學研究院Julien Vermot研究組在《Science》,發表了題為“Bioelectric signaling and the control of cardiac cell identity inresponse to mechanical forces”的文章,闡述了心血管瓣膜的形成過程以及機械應力在此過程中的調控機制。

機械力,如流體剪切應力和由血流和心跳產生的拉伸力,廣泛存在于血液循環中。在心臟內部,心內膜細胞(EdCs)將力信號轉化為細胞生化信號,誘導形成瓣膜,并且根據所屬的心臟區域對力信號有不同的反應。在本研究中,以斑馬魚作為生物模型,研究了機械力調節特定的心內膜向瓣膜發育的過程。
研究者們首先利用斑馬魚為生物模型對時空機械應力參數進行高精度控制,利用熒光探針(Tg)對EdCs中表達的熒光Ca2+傳感器蛋白GCaMP7a進行實時成像,以監控分析心內膜細胞中的Ca2+的動態變化,結果發現Ca2+振蕩幾乎只會在房室瓣的房室管區域形成,因此研究者們推測,Ca2+振蕩是瓣膜形成的重要因素。
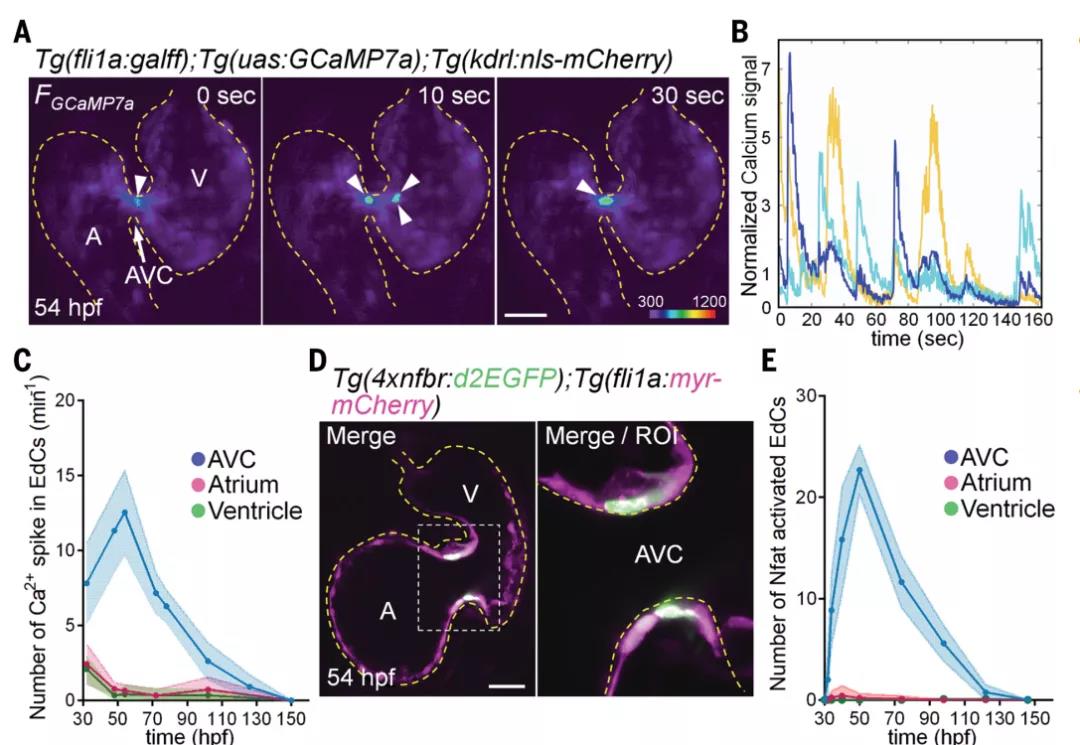
在以往的研究中已經發現,活化T細胞核因子1 (Nuclear factor of activated T cells 1, Nfatc1)是一種已知的Ca2+ 敏感的轉錄因子,可調節心內膜-間充質轉化和心臟瓣膜形態發生。因此研究者們通過綠色熒光蛋白(GFP)熒光標記Nfatc1,來監測Ca2+ 信號通路。
為了確定在EdCs中觀察到的Ca2+振蕩是否是力響應的,研究者們利用藥物(MS-222 、 p-amino)使斑馬魚停止心跳,實驗結果表明,當心臟停止跳動時,EdCs中的Ca2+振蕩消失,而在心跳重啟后恢復。這也驗證了Ca2+振蕩與心內膜細胞EdCs的應力響應。
進一步地,研究者們希望通過操縱血管瓣膜邊界處的機械應力對機械力改變所帶來的效應進行檢測。研究者們將一個30-60μm的瓊脂磁珠插入到心血管腔中,在通過磁鑷操縱磁珠來改變血管瓣膜邊界處的機械力,并記錄Ca2+的變化。結果顯示,通過外力引起的機械力的變化會導致心臟瓣膜定位異常,進一步證明了Ca2+振蕩與心內膜細胞(EdCs)機械應力密切相關。
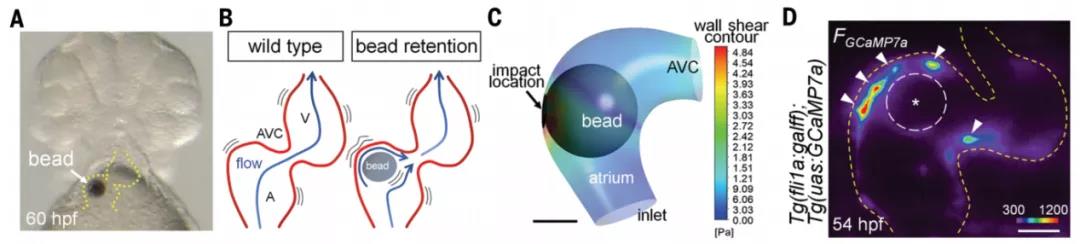
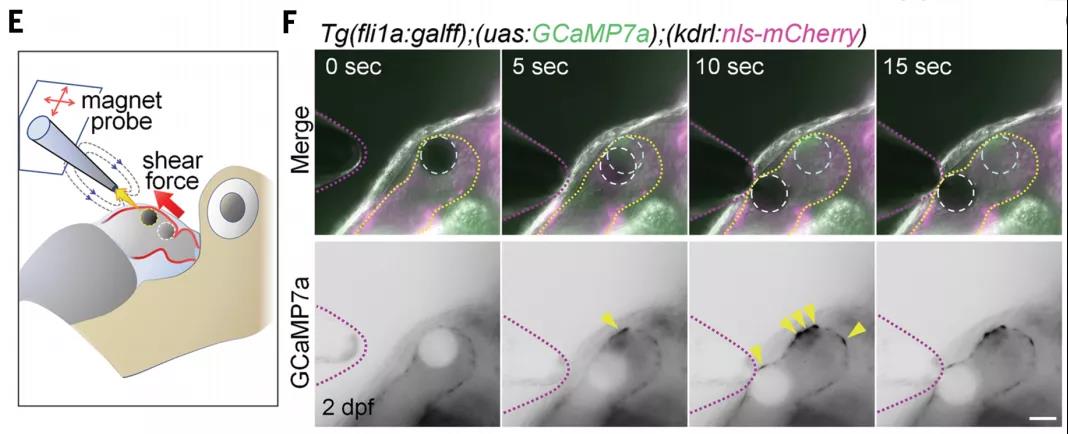
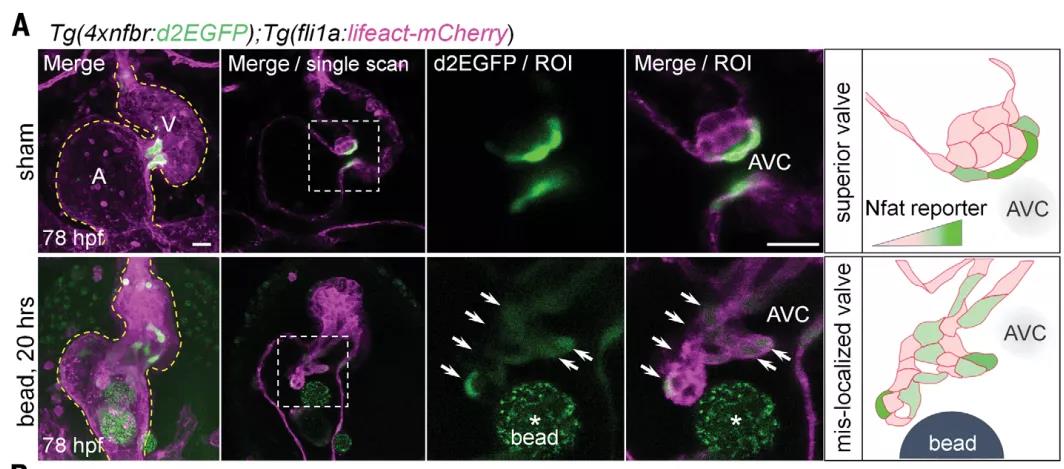
那么當應力發生錯誤的時候,是否對瓣膜形態形成和發育有影響呢?在心房內珠移植16-20小時后,在磁珠附近觀察到瓣膜樣的團簇。假手術空白組形成了房室管區域的瓣膜,然而,加入磁珠的實驗組,心房和心室區也可見瓣膜樣結構,也就是磁珠造成了瓣膜生長錯亂。
此外,研究者們還發現ATP(腺嘌呤核苷三磷酸)通過嘌呤能受體P2X通道激活Ca2+信號,使Ca2+內流。通過微注入法,將oligomycin A(清除ATP),apyrase (一種ATP水解酶), apyrase (一種ATP水解酶)(ATP類似物)注入到心腔,細胞外ATP水平顯著影響Ca2+顯著變化。因此,P2X通道可以調節EdCs中的Ca2+內流并響應細胞外ATP水平的變化,是Nfatc1信號通路的上游,在機械力刺激下控制瓣膜發育。
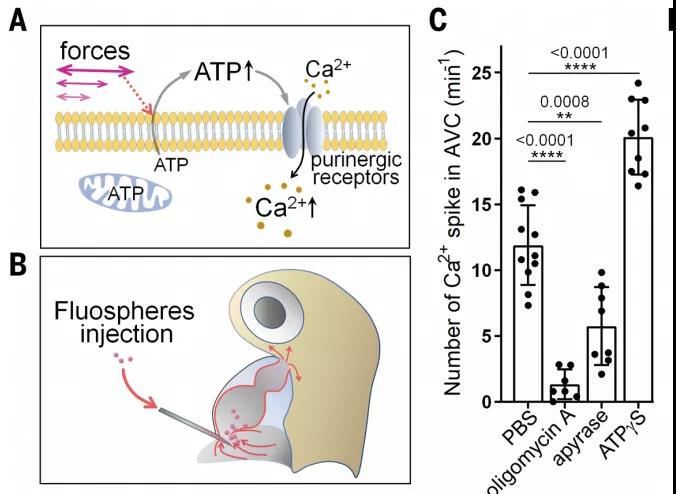
在本研究中,研究者們確定了ATP-Ca2+是在心血管形成和瓣膜發育中形成的延伸調控通道,通過血流動力學機械力可以指導心臟瓣膜的發育。因此,ATP可以幫助心臟瓣膜在體外生長,并有可能用到先天性心臟瓣膜缺陷等疾病的治療中。
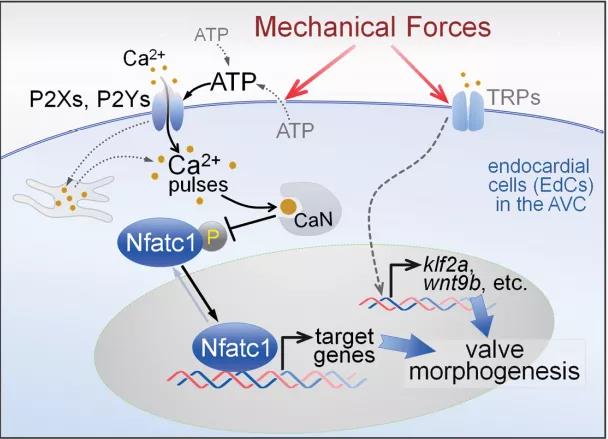
總結,這項工作表明生物系統依賴于多種機械力敏感途徑來精確控制形態發生過程,這也是一種保障機制,可以增強機械力調控的穩健性,避免心臟異位瓣膜形成,是生命進化的自我調控機制,也為解決相關疾病的研究提供了可靠的理論基礎,在攻克心臟疾病的道路上具有很重要的意義。



