嚴重急性呼吸系統綜合征冠狀病毒2型(Severe Acute Respiratory Syndrome Coronavirus 2,SARS-CoV-2)造成了新型冠狀病毒肺炎(Corona Virus Disease 2019,COVID-19)的大流行。盡管COVID-19疫苗的研發取得了巨大的成功,但由于毒株的頻繁變異和全球較低的疫苗接種率,SARS-CoV- 2大流行對人類健康帶來了持久的挑戰,因此迫切需要研發針對SARS-CoV-2變異毒株的新型廣譜治療方法。
美國西北大學醫學院和美國德州大學MD安德森癌癥中心在Nature Communications雜志上發表了一項新發現,該研究發現新冠肺炎患者的血液中存在含有血管緊張素轉化酶2蛋白的天然納米級大小的囊泡-evACE2,它具有先天廣譜抗病毒機制,可阻止不同變異類型新冠病毒毒株的感染,包括已經出現的多種新冠病毒變異株和未來可能出現的冠狀病毒。

研究成果(圖源:Nature Communications)
SARS-CoV-2的野生株(WT)和突變株通過進入受體血管緊張素轉換酶2(Angiotensin Converting Enzyme 2,ACE2)感染宿主細胞,如人肺細胞。細胞外囊泡(Extracellular vesicles,EV)是血液等液體的重要組成部分之一,包括外泌體和微囊泡。外泌體是具特征的小型EV之一,可能參與多種生理和病理生物學功能,或可作為新的生物標記物和下一代生物療法。從植物和人類樣本中提取的外泌體已應用于臨床試驗,用于治療炎癥性疾病和癌癥。根據EV領域廣泛采用的命名法以及分離異源囊泡群的可能性,研究人員將其中富集的外泌體統稱為“EVs”。
研究人員對人類血漿樣品中的EVs進行MFV分析,發現COVID-19患者的血漿中ACE2+EVs升高,與血清陰性對照組相比,急性期有較大幅度的增加,恢復期有適度的增加。SARS-CoV-2感染觸發了過量表達ACE2的人肺細胞A549細胞分泌ACE2+TSG101+EVs,這意味著ACE2+EVs上調是COVID-19患者對SARS-CoV-2感染的先天反應。
研究人員應用人類細胞系HEK-293(HEK)和HeLa,用于表征EVs中ACE2表達,并測定evACE2對SARS-CoV-2的結合活性和中和功能。實驗表明,evACE2富集在小的EVs中,在假定的外泌體中檢測到的可能性很小。進一步研究表明,SARS-CoV-2進入受體ACE2蛋白,在EVs上表達。
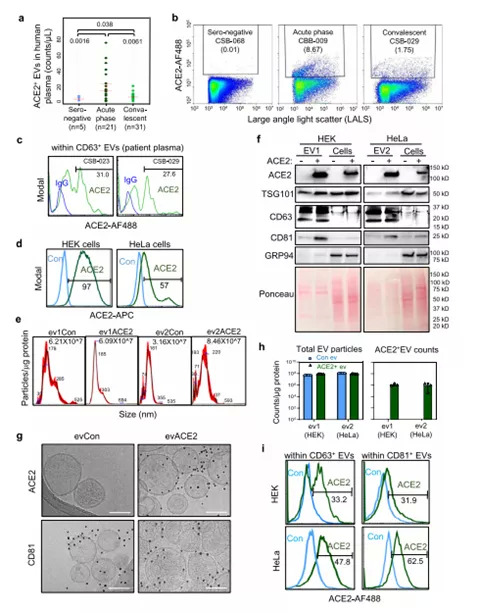
COVID-19患者的外周血中EVs增加(圖源:Nature Communications)
研究人員通過評估SARS-CoV-2 蛋白與人類宿主細胞的結合來分析evACE2對病毒附著和感染的影響。正如預期的那樣,ACE2HEK細胞與紅色熒光團AF-647結合的RBD蛋白表現出特異且穩定的結合。相比之下,等量的ACE2EV的效果可以忽略不計,這表明ACE2EV通過誘導ACE2抑制其細胞受體ACE2對EV的SARS-CoV-2 RBD識別。作為陽性對照,rhACE2也抑制RBD與人類ACE2細胞的結合。對比分析發現,evACE2比rhACE2更有效地阻斷SARS-CoV-2 RBD與人類宿主細胞的結合。
接下來,研究人員又評估了evACE2和rhACE2對SARS-CoV-2及其變種的中和作用。結果表明,與rhACE2相比,ev1ACE2(HEK)和ev2ACE2(HeLa)在阻斷假病毒感染方面的中和效率估計分別高出58倍和34倍。鑒于實驗設置限制,還需進一步實驗。實驗數據表明,evACE2在阻斷SARS-CoV-2病毒感染方面至少達到了估計的80倍的中和效果,PCR測試也驗證了這一結果。
為了研究evACE2中和SARSCoV-2變體的潛力,團隊采用假型和真實SARS-CoV-2感染試驗。與WT相比,evACE2在阻斷假型SARS-CoV-2變體的感染方面取得了高達4至5倍的功效,這些變體表達了B1.1.7(α變體)、B1.351(β變體)和B.1.617.2(δ變體)的S蛋白突變體。在evACE2介導的對SARS-CoV-2變體的中和作用中也得到了類似的結果,其中evACE2對α和β變體的感染的抑制效果與WT相似或更大。總而言之,研究結果支持evACE2作為一種創新方法來預防或限制SARS-CoV-2病毒感染,包括WT和變異株。
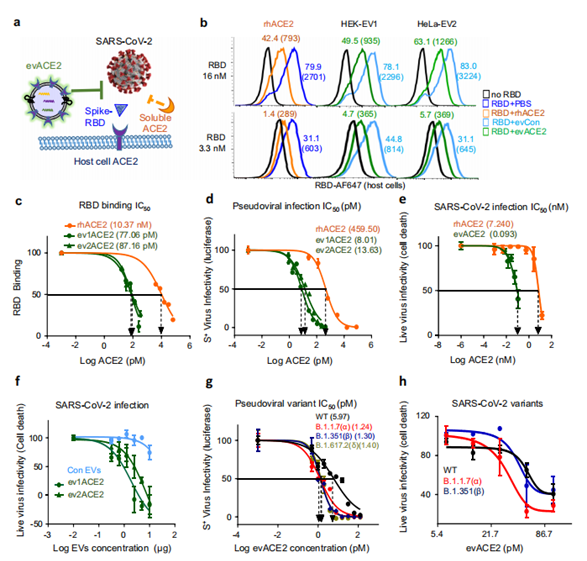
evACE2對RBD結合和SARS-CoV-2變異感染的中和作用(圖源:Nature Communications)
先前研究發現evACE2可能存在先天抗病毒機制,研究人員對此進行了細致研究。血漿中和活性對ACE2+EVs和RBD-IgG水平的多變量線性回歸顯示比單獨的RBD-IgG水平提高(模型的擬合度),這一結果支持ACE2+EVs具有潛在抗病毒貢獻。為了確定血漿EVs對中和功能的貢獻,研究人員從血清陰性對照組和COVID-19患者的血漿樣品中分離出EVs,質譜分析證實了ACE2和EV蛋白的存在。
值得注意的是,從6名急性期COVID-19患者中的5名血漿中分離出的EV顆粒,尤其是CBB-007和CBB-012(未檢測到RBD-IgG)完全阻斷了SARS-CoV-2感染引起的細胞死亡。血清陰性對照組和沒有檢測到ACE2 EVs的CBB-005未顯示任何病毒中和作用,這表明血漿中的ACE2+ EVs水平可能受SARS-CoV2感染調控。因此,研究人員又耗盡血漿顆粒中的大部分ACE2+EVs,其從五個血漿樣本(康復期的CSB-012和CSB-24,以及急性期的CBB-008、009和013)中分離出的ACE2+EVs的耗竭,明顯削弱了血漿EVs中和RBD與ACE2+HEK細胞結合的能力,這表明COVID-19患者血漿中的ACE2+EVs至少是抗SARS-CoV-2活性的部分原因。
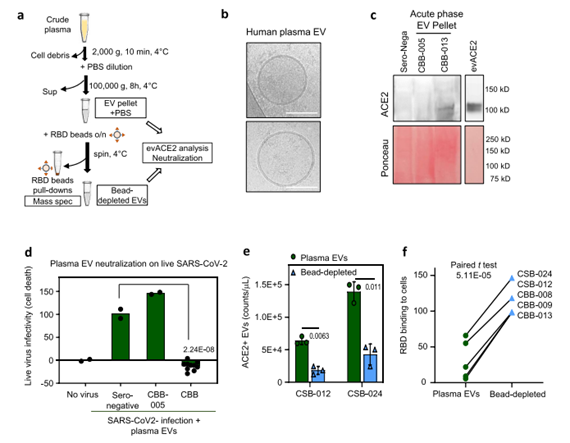
患者血漿中的evACE2能中和SARS-CoV-2(圖源:Nature Communications)
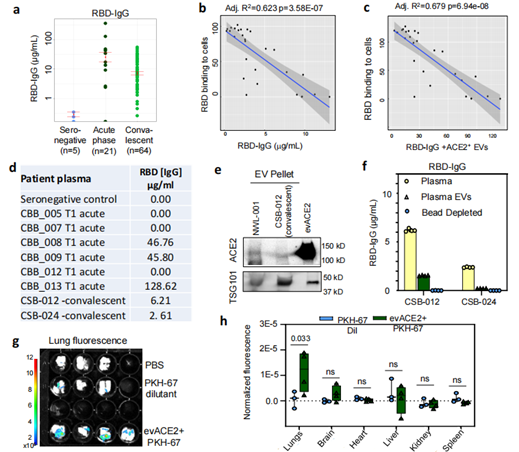
治療性evACE2的患者血漿分析和小鼠生物分布情況(圖源:Nature Communications)
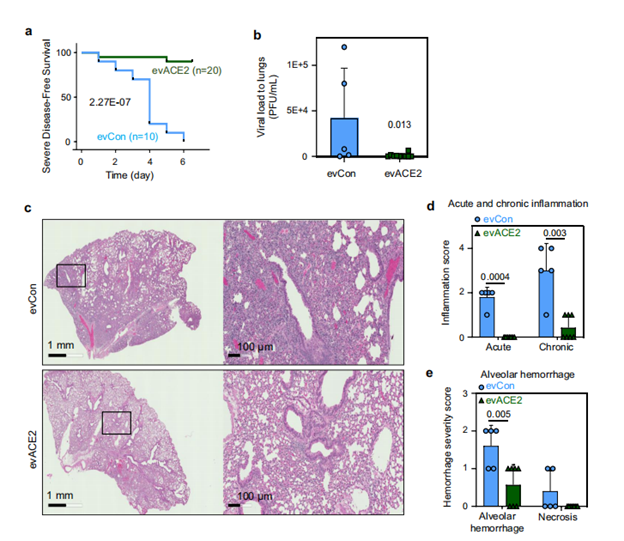
為了驗證發現的evACE2是否能作為治療COVID-19的誘餌療法,研究人員使用已建立的hACE2轉基因COVID-19小鼠模型評估了其臨床前療效。雙盲病理評分顯示,evACE2治療在很大程度上減少了SARS-CoV-2感染小鼠的肺部炎癥。與對照組EV治療的小鼠相比,肺泡出血和壞死評分明顯降低。進一步驗證鼻腔遞送的ACE2+EVs的研究表明,evACE2在治療COVID-19發病機制方面取得了良好的臨床前療效。
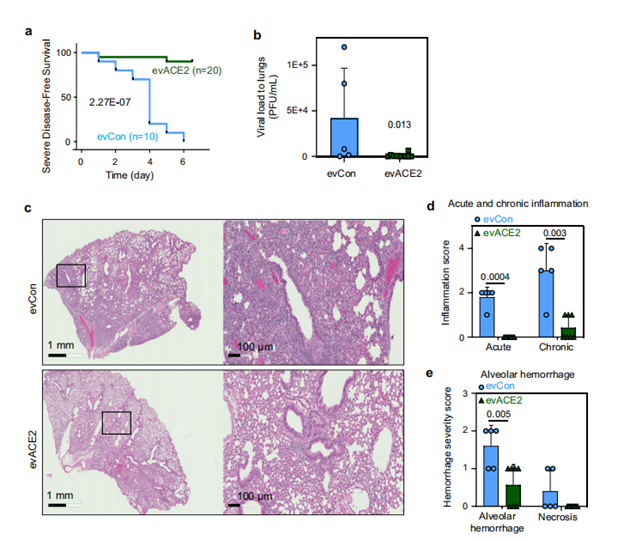
 (圖源:Nature Communications)
(圖源:Nature Communications)研究團隊已經確定evACE2是一種創新的誘餌療法,可以有效地阻斷SARS-CoV-2及其變體引起的傳染病,并可能阻斷所有未來出現的利用ACE2作為其初始連接受體的冠狀病毒。目前,團隊正在申請有關evACE2的專利,開發evACE2作為預防和治療新冠肺炎的生物治療產品。
參考資料:
嚴重急性呼吸系統綜合征冠狀病毒2型(Severe Acute Respiratory Syndrome Coronavirus 2,SARS-CoV-2)造成了新型冠狀病毒肺炎(Corona Virus Disease 2019,COVID-19)的大流行。盡管COVID-19疫苗的研發取得了巨大的成功,但由于毒株的頻繁變異和全球較低的疫苗接種率,SARS-CoV- 2大流行對人類健康帶來了持久的挑戰,因此迫切需要研發針對SARS-CoV-2變異毒株的新型廣譜治療方法。
美國西北大學醫學院和美國德州大學MD安德森癌癥中心在Nature Communications雜志上發表了一項新發現,該研究發現新冠肺炎患者的血液中存在含有血管緊張素轉化酶2蛋白的天然納米級大小的囊泡-evACE2,它具有先天廣譜抗病毒機制,可阻止不同變異類型新冠病毒毒株的感染,包括已經出現的多種新冠病毒變異株和未來可能出現的冠狀病毒。

研究成果(圖源:Nature Communications)
SARS-CoV-2的野生株(WT)和突變株通過進入受體血管緊張素轉換酶2(Angiotensin Converting Enzyme 2,ACE2)感染宿主細胞,如人肺細胞。細胞外囊泡(Extracellular vesicles,EV)是血液等液體的重要組成部分之一,包括外泌體和微囊泡。外泌體是具特征的小型EV之一,可能參與多種生理和病理生物學功能,或可作為新的生物標記物和下一代生物療法。從植物和人類樣本中提取的外泌體已應用于臨床試驗,用于治療炎癥性疾病和癌癥。根據EV領域廣泛采用的命名法以及分離異源囊泡群的可能性,研究人員將其中富集的外泌體統稱為“EVs”。
研究人員對人類血漿樣品中的EVs進行MFV分析,發現COVID-19患者的血漿中ACE2+EVs升高,與血清陰性對照組相比,急性期有較大幅度的增加,恢復期有適度的增加。SARS-CoV-2感染觸發了過量表達ACE2的人肺細胞A549細胞分泌ACE2+TSG101+EVs,這意味著ACE2+EVs上調是COVID-19患者對SARS-CoV-2感染的先天反應。
研究人員應用人類細胞系HEK-293(HEK)和HeLa,用于表征EVs中ACE2表達,并測定evACE2對SARS-CoV-2的結合活性和中和功能。實驗表明,evACE2富集在小的EVs中,在假定的外泌體中檢測到的可能性很小。進一步研究表明,SARS-CoV-2進入受體ACE2蛋白,在EVs上表達。

COVID-19患者的外周血中EVs增加(圖源:Nature Communications)
研究人員通過評估SARS-CoV-2 蛋白與人類宿主細胞的結合來分析evACE2對病毒附著和感染的影響。正如預期的那樣,ACE2HEK細胞與紅色熒光團AF-647結合的RBD蛋白表現出特異且穩定的結合。相比之下,等量的ACE2EV的效果可以忽略不計,這表明ACE2EV通過誘導ACE2抑制其細胞受體ACE2對EV的SARS-CoV-2 RBD識別。作為陽性對照,rhACE2也抑制RBD與人類ACE2細胞的結合。對比分析發現,evACE2比rhACE2更有效地阻斷SARS-CoV-2 RBD與人類宿主細胞的結合。
接下來,研究人員又評估了evACE2和rhACE2對SARS-CoV-2及其變種的中和作用。結果表明,與rhACE2相比,ev1ACE2(HEK)和ev2ACE2(HeLa)在阻斷假病毒感染方面的中和效率估計分別高出58倍和34倍。鑒于實驗設置限制,還需進一步實驗。實驗數據表明,evACE2在阻斷SARS-CoV-2病毒感染方面至少達到了估計的80倍的中和效果,PCR測試也驗證了這一結果。
為了研究evACE2中和SARSCoV-2變體的潛力,團隊采用假型和真實SARS-CoV-2感染試驗。與WT相比,evACE2在阻斷假型SARS-CoV-2變體的感染方面取得了高達4至5倍的功效,這些變體表達了B1.1.7(α變體)、B1.351(β變體)和B.1.617.2(δ變體)的S蛋白突變體。在evACE2介導的對SARS-CoV-2變體的中和作用中也得到了類似的結果,其中evACE2對α和β變體的感染的抑制效果與WT相似或更大。總而言之,研究結果支持evACE2作為一種創新方法來預防或限制SARS-CoV-2病毒感染,包括WT和變異株。

evACE2對RBD結合和SARS-CoV-2變異感染的中和作用(圖源:Nature Communications)
先前研究發現evACE2可能存在先天抗病毒機制,研究人員對此進行了細致研究。血漿中和活性對ACE2+EVs和RBD-IgG水平的多變量線性回歸顯示比單獨的RBD-IgG水平提高(模型的擬合度),這一結果支持ACE2+EVs具有潛在抗病毒貢獻。為了確定血漿EVs對中和功能的貢獻,研究人員從血清陰性對照組和COVID-19患者的血漿樣品中分離出EVs,質譜分析證實了ACE2和EV蛋白的存在。
值得注意的是,從6名急性期COVID-19患者中的5名血漿中分離出的EV顆粒,尤其是CBB-007和CBB-012(未檢測到RBD-IgG)完全阻斷了SARS-CoV-2感染引起的細胞死亡。血清陰性對照組和沒有檢測到ACE2 EVs的CBB-005未顯示任何病毒中和作用,這表明血漿中的ACE2+ EVs水平可能受SARS-CoV2感染調控。因此,研究人員又耗盡血漿顆粒中的大部分ACE2+EVs,其從五個血漿樣本(康復期的CSB-012和CSB-24,以及急性期的CBB-008、009和013)中分離出的ACE2+EVs的耗竭,明顯削弱了血漿EVs中和RBD與ACE2+HEK細胞結合的能力,這表明COVID-19患者血漿中的ACE2+EVs至少是抗SARS-CoV-2活性的部分原因。

患者血漿中的evACE2能中和SARS-CoV-2(圖源:Nature Communications)

治療性evACE2的患者血漿分析和小鼠生物分布情況(圖源:Nature Communications)
為了驗證發現的evACE2是否能作為治療COVID-19的誘餌療法,研究人員使用已建立的hACE2轉基因COVID-19小鼠模型評估了其臨床前療效。雙盲病理評分顯示,evACE2治療在很大程度上減少了SARS-CoV-2感染小鼠的肺部炎癥。與對照組EV治療的小鼠相比,肺泡出血和壞死評分明顯降低。進一步驗證鼻腔遞送的ACE2+EVs的研究表明,evACE2在治療COVID-19發病機制方面取得了良好的臨床前療效。

 (圖源:Nature Communications)
(圖源:Nature Communications)研究團隊已經確定evACE2是一種創新的誘餌療法,可以有效地阻斷SARS-CoV-2及其變體引起的傳染病,并可能阻斷所有未來出現的利用ACE2作為其初始連接受體的冠狀病毒。目前,團隊正在申請有關evACE2的專利,開發evACE2作為預防和治療新冠肺炎的生物治療產品。
參考資料:



