摘要:研究人員揭示了包括SARS-CoV-2、SARS-CoV-1和MERS-CoV在內的冠狀病毒如何利用一種稱為“半胱氨酸天冬氨酸蛋白酶6”(Caspase-6)的宿主蛋白酶進行有效復制的機制。
冠狀病毒的核糖核酸(RNA)進入宿主細胞后,會觸發感染細胞分泌干擾素,抑制病毒在感染細胞內復制,降低其他未感染細胞之間的感染風險。同時,宿主細胞也會發生凋亡過程,即程序化的細胞死亡過程,使細胞不再成為病毒復制的工廠。因此,干擾素反應和細胞凋亡是人類和動物細胞中很重要的抗病毒機制。
細胞凋亡是由半胱氨酸-天冬氨酸蛋白酶在人和動物細胞中執行的,通過該蛋白酶清除感染細胞以抑制病毒復制。香港大學醫學院的研究小組研究了caspase-6在一系列細胞系、人離體肺組織、人腸道類器官和動物模型中對冠狀病毒復制的影響。研究小組發現,caspase-6的化學抑制或基因缺失顯著降低了冠狀病毒的復制,而過表達caspase-6有效地促進了冠狀病毒的復制。
圖1 caspase-6在一系列細胞系、人離體肺組織、人腸道類器官和動物模型中對冠狀病毒復制的影響(圖源:[1])
研究方法和結果
在小鼠模型中,caspase-6的化學抑制劑極大地限制了小鼠適應的MERS-CoV (MERS-CoVMA)的復制,并顯著地將小鼠的存活率從33.3%提高到80%。此外,在caspase-6敲除小鼠的肺中,MERS-CoVMA復制和MERS-CoVMA誘導的肺損傷明顯減少。同樣,在倉鼠模型中,針對caspase-6的特異性化學抑制劑減少了SARS-CoV-2的復制和相關的炎癥性肺損傷。
但冠狀病毒如何利用caspase-6來造福自己呢?請注意,干擾素反應是宿主細胞重要和直接的抗病毒防御。我們的進一步研究發現,caspase-6可以切割冠狀病毒核衣殼(N)蛋白,產生N個片段,與宿主的“干擾素調控因子3 (IRF3)”相互作用,阻止其進入細胞核啟動干擾素應答。因此,病毒N片段作為干擾素拮抗劑,促進病毒復制。
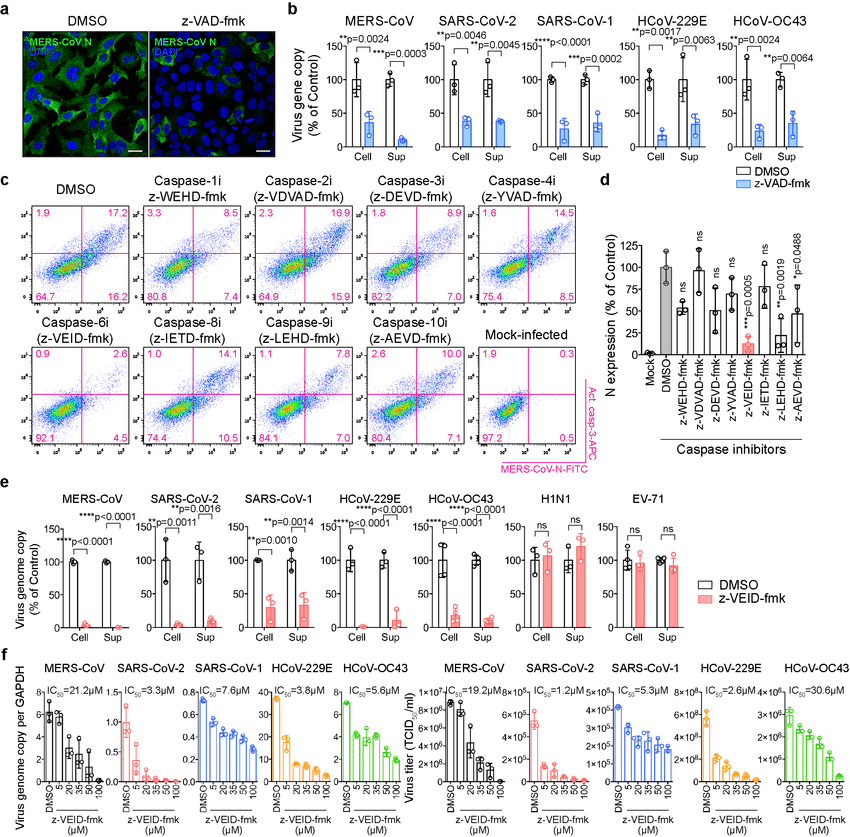
圖2 在小鼠模型中,caspase-6的化學抑制劑極大地限制了小鼠適應的MERS-CoV (MERS-CoVMA)的復制(圖源:[1])
研究意義
這項研究顯示了冠狀病毒是如何進化成很成功的病原體的。我們揭示了冠狀病毒如何克服宿主細胞對干擾素反應的抗病毒防御的一種新機制,通過開發一類新的宿主蛋白酶,caspase-6,該蛋白酶原本是宿主用來執行細胞凋亡,作為一種防御病毒感染,以獲得更好的病毒復制。這些結果進一步表明,可以設計針對caspase-6的藥物,它可以成為所有已知人類冠狀病毒感染抗病毒治療的潛在干預目標。
參考資料:
[1] Hin Chu, Yuxin Hou, Dong Yang, Lei Wen, Huiping Shuai, Chaemin Yoon, Jialu Shi, Yue Chai, Terrence Tsz-Tai Yuen, Bingjie Hu, Cun Li, Xiaoyu Zhao, Yixin Wang, Xiner Huang, Kin Shing Lee, Luo Cuiting, Jian-Piao Cai, Vincent Kwok-Man Poon, Chris Chung-Sing Chan, Anna Jinxia Zhang, Shuofeng Yuan, Ko-Yung Sit, Dominic Chi-Chung Foo, Wing-Kuk Au, Kenneth Kak-Yuen Wong, Jie Zhou, Kin-Hang Kok, Dong-Yan Jin, Jasper Fuk-Woo Chan, Kwok-Yung Yuen. Coronaviruses exploit a host cysteine-aspartic protease for replication. Nature, 2022
摘要:研究人員揭示了包括SARS-CoV-2、SARS-CoV-1和MERS-CoV在內的冠狀病毒如何利用一種稱為“半胱氨酸天冬氨酸蛋白酶6”(Caspase-6)的宿主蛋白酶進行有效復制的機制。
冠狀病毒的核糖核酸(RNA)進入宿主細胞后,會觸發感染細胞分泌干擾素,抑制病毒在感染細胞內復制,降低其他未感染細胞之間的感染風險。同時,宿主細胞也會發生凋亡過程,即程序化的細胞死亡過程,使細胞不再成為病毒復制的工廠。因此,干擾素反應和細胞凋亡是人類和動物細胞中重要的抗病毒機制。
細胞凋亡是由半胱氨酸-天冬氨酸蛋白酶在人和動物細胞中執行的,通過該蛋白酶清除感染細胞以抑制病毒復制。香港大學醫學院的研究小組研究了caspase-6在一系列細胞系、人離體肺組織、人腸道類器官和動物模型中對冠狀病毒復制的影響。研究小組發現,caspase-6的化學抑制或基因缺失顯著降低了冠狀病毒的復制,而過表達caspase-6有效地促進了冠狀病毒的復制。

圖1 caspase-6在一系列細胞系、人離體肺組織、人腸道類器官和動物模型中對冠狀病毒復制的影響(圖源:[1])
研究方法和結果
在小鼠模型中,caspase-6的化學抑制劑極大地限制了小鼠適應的MERS-CoV (MERS-CoVMA)的復制,并顯著地將小鼠的存活率從33.3%提高到80%。此外,在caspase-6敲除小鼠的肺中,MERS-CoVMA復制和MERS-CoVMA誘導的肺損傷明顯減少。同樣,在倉鼠模型中,針對caspase-6的特異性化學抑制劑減少了SARS-CoV-2的復制和相關的炎癥性肺損傷。
但冠狀病毒如何利用caspase-6來造福自己呢?請注意,干擾素反應是宿主細胞重要和直接的抗病毒防御。我們的進一步研究發現,caspase-6可以切割冠狀病毒核衣殼(N)蛋白,產生N個片段,與宿主的“干擾素調控因子3 (IRF3)”相互作用,阻止其進入細胞核啟動干擾素應答。因此,病毒N片段作為干擾素拮抗劑,促進病毒復制。

圖2 在小鼠模型中,caspase-6的化學抑制劑極大地限制了小鼠適應的MERS-CoV (MERS-CoVMA)的復制(圖源:[1])
研究意義
這項研究顯示了冠狀病毒是如何進化成很成功的病原體的。我們揭示了冠狀病毒如何克服宿主細胞對干擾素反應的抗病毒防御的一種新機制,通過開發一類新的宿主蛋白酶,caspase-6,該蛋白酶原本是宿主用來執行細胞凋亡,作為一種防御病毒感染,以獲得更好的病毒復制。這些結果進一步表明,可以設計針對caspase-6的藥物,它可以成為所有已知人類冠狀病毒感染抗病毒治療的潛在干預目標。
參考資料:
[1] Hin Chu, Yuxin Hou, Dong Yang, Lei Wen, Huiping Shuai, Chaemin Yoon, Jialu Shi, Yue Chai, Terrence Tsz-Tai Yuen, Bingjie Hu, Cun Li, Xiaoyu Zhao, Yixin Wang, Xiner Huang, Kin Shing Lee, Luo Cuiting, Jian-Piao Cai, Vincent Kwok-Man Poon, Chris Chung-Sing Chan, Anna Jinxia Zhang, Shuofeng Yuan, Ko-Yung Sit, Dominic Chi-Chung Foo, Wing-Kuk Au, Kenneth Kak-Yuen Wong, Jie Zhou, Kin-Hang Kok, Dong-Yan Jin, Jasper Fuk-Woo Chan, Kwok-Yung Yuen. Coronaviruses exploit a host cysteine-aspartic protease for replication. Nature, 2022



