摘要:對PAP肺部疾病病因的新發(fā)現(xiàn)也可以為診治肥胖和心臟病提供解決方案。芬蘭圖爾庫大學亞歷山大·米爾德納副教授的研究小組發(fā)現(xiàn)了一種導致肺泡中脂質積累的基因缺陷。
肺泡是位于支氣管末端的微小氣泡狀氣囊。它們是生存的關鍵,因為它們將氧氣轉化為二氧化碳。
肺泡被一層稱為表面活性劑的薄液膜所覆蓋,表面活性劑主要由脂類組成。表面活性劑不僅能保護肺部免受空氣中的病原體和灰塵的侵害,還能通過降低肺泡表面張力促進正常呼吸。
表面活性劑脂質不斷產(chǎn)生并從肺泡中清除。肺泡巨噬細胞,肺的免疫清除細胞,降解和循環(huán)表面活性劑脂類。肺泡巨噬細胞發(fā)育和功能的缺陷導致表面活性劑平衡紊亂和表面活性劑脂質的病理積累,堵塞肺泡間隙。積聚的脂質使巨噬細胞膨脹并產(chǎn)生泡沫。
“我們可以在肺泡蛋白沉積癥(PAP)患者中觀察到這種現(xiàn)象。他們呼吸短促,呼吸功能受損,肺部感染的風險增加。這是一種相對罕見的疾病,”芬蘭圖爾庫大學InFLAMES旗艦項目的Alexander Mildner副教授說。他與德國柏林Max-Delbrück中心的Achim Leutz教授小組合作領導了這項研究。

圖1 研究發(fā)現(xiàn)積聚的脂質使巨噬細胞膨脹并產(chǎn)生泡沫(圖源:[1])
巨噬細胞缺乏必要的細胞工具
基因調控的紊亂導致巨噬細胞的缺陷。其中一種干擾已經(jīng)被發(fā)現(xiàn),但米爾德納和他的團隊發(fā)現(xiàn),缺少第二種調節(jié)因子會使巨噬細胞無法清除表面活性劑中的脂質。
“這種調控基因就是轉錄因子C/EBPb。我們觀察到缺乏C/ eppb的巨噬細胞缺乏清除脂質所需的細胞工具,”Mildner解釋說。
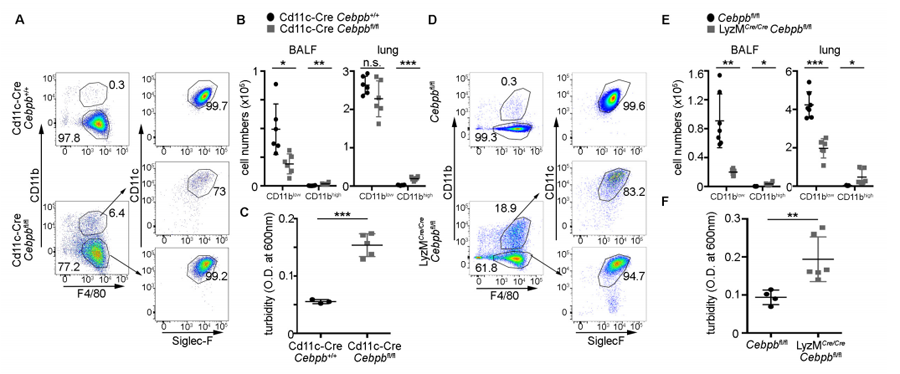
圖2 根據(jù)Cebpb缺乏小鼠的肺泡巨噬細胞分析(圖源:[1])
這項新發(fā)現(xiàn)的意義不僅局限于PAP疾病。肥胖或動脈粥樣硬化患者中也有腫脹的泡沫狀巨噬細胞。
“也許我們可以借鑒肺部的肺泡巨噬細胞,將我們的發(fā)現(xiàn)轉化為其他巨噬細胞,幫助它們更有效地消化脂質。未來,有可能通過藥物激活肥胖、PAP或動脈粥樣硬化患者的巨噬細胞C/ eppb - pparg2網(wǎng)絡,并促進這些細胞的脂質消化。這可能為診治這些患者提供新的策略,”米爾德納說。
參考資料:
[1] C/EBPβ regulates lipid metabolism and Pparg isoform 2 expression in alveolar macrophages
摘要:對PAP肺部疾病病因的新發(fā)現(xiàn)也可以為診治肥胖和心臟病提供解決方案。芬蘭圖爾庫大學亞歷山大·米爾德納副教授的研究小組發(fā)現(xiàn)了一種導致肺泡中脂質積累的基因缺陷。
肺泡是位于支氣管末端的微小氣泡狀氣囊。它們是生存的關鍵,因為它們將氧氣轉化為二氧化碳。
肺泡被一層稱為表面活性劑的薄液膜所覆蓋,表面活性劑主要由脂類組成。表面活性劑不僅能保護肺部免受空氣中的病原體和灰塵的侵害,還能通過降低肺泡表面張力促進正常呼吸。
表面活性劑脂質不斷產(chǎn)生并從肺泡中清除。肺泡巨噬細胞,肺的免疫清除細胞,降解和循環(huán)表面活性劑脂類。肺泡巨噬細胞發(fā)育和功能的缺陷導致表面活性劑平衡紊亂和表面活性劑脂質的病理積累,堵塞肺泡間隙。積聚的脂質使巨噬細胞膨脹并產(chǎn)生泡沫。
“我們可以在肺泡蛋白沉積癥(PAP)患者中觀察到這種現(xiàn)象。他們呼吸短促,呼吸功能受損,肺部感染的風險增加。這是一種相對罕見的疾病,”芬蘭圖爾庫大學InFLAMES旗艦項目的Alexander Mildner副教授說。他與德國柏林Max-Delbrück中心的Achim Leutz教授小組合作領導了這項研究。

圖1 研究發(fā)現(xiàn)積聚的脂質使巨噬細胞膨脹并產(chǎn)生泡沫(圖源:[1])
巨噬細胞缺乏必要的細胞工具
基因調控的紊亂導致巨噬細胞的缺陷。其中一種干擾已經(jīng)被發(fā)現(xiàn),但米爾德納和他的團隊發(fā)現(xiàn),缺少第二種調節(jié)因子會使巨噬細胞無法清除表面活性劑中的脂質。
“這種調控基因就是轉錄因子C/EBPb。我們觀察到缺乏C/ eppb的巨噬細胞缺乏清除脂質所需的細胞工具,”Mildner解釋說。

圖2 根據(jù)Cebpb缺乏小鼠的肺泡巨噬細胞分析(圖源:[1])
這項新發(fā)現(xiàn)的意義不僅局限于PAP疾病。肥胖或動脈粥樣硬化患者中也有腫脹的泡沫狀巨噬細胞。
“也許我們可以借鑒肺部的肺泡巨噬細胞,將我們的發(fā)現(xiàn)轉化為其他巨噬細胞,幫助它們更有效地消化脂質。未來,有可能通過藥物激活肥胖、PAP或動脈粥樣硬化患者的巨噬細胞C/ eppb - pparg2網(wǎng)絡,并促進這些細胞的脂質消化。這可能為診治這些患者提供新的策略,”米爾德納說。
參考資料:
[1] C/EBPβ regulates lipid metabolism and Pparg isoform 2 expression in alveolar macrophages



