摘要:哈佛大學(xué)威斯生物激勵工程研究所的一項(xiàng)新進(jìn)展克服了目前在空間轉(zhuǎn)錄組學(xué)方面的局限性,采用了一種名為“Light-Seq”的DNA納米技術(shù)驅(qū)動方法。Light-Seq允許研究人員用專屬于少數(shù)感興趣細(xì)胞的獨(dú)特DNA條形碼對全部RNA序列進(jìn)行“地理標(biāo)記”。
在顯微鏡下,研究人員經(jīng)常觀察到不同類型的細(xì)胞在組織中以獨(dú)特的模式自我組織,或者有時一種罕見的細(xì)胞類型通過占據(jù)獨(dú)特的位置、顯示出不尋常的形狀或表達(dá)特定的生物標(biāo)記分子而脫穎而出。為了確定他們觀察到的更深層次的意義,他們開發(fā)了一種方法,通過分析細(xì)胞中存在的基因來源的RNA分子來訪問細(xì)胞的基因表達(dá)模式(轉(zhuǎn)錄組),他們可以將其與細(xì)胞的形狀、空間位置和分子生物標(biāo)記進(jìn)行匹配。
然而,這些“空間轉(zhuǎn)錄組學(xué)”方法仍然只能捕獲細(xì)胞總RNA分子的一小部分,不能提供單細(xì)胞測序方法提供的深度和質(zhì)量分析,單細(xì)胞測序方法是為了研究從組織或生物液體中分離出來的單個細(xì)胞的轉(zhuǎn)錄組而開發(fā)的通過下一代測序(NGS)技術(shù)。它們也不允許研究人員僅根據(jù)細(xì)胞在組織中的位置鎖定特定細(xì)胞,這將極大地促進(jìn)研究分離的細(xì)胞群,或罕見的、難以分離的細(xì)胞,如具有獨(dú)特功能的罕見腦細(xì)胞,或入侵腫瘤的免疫細(xì)胞。此外,由于原始組織環(huán)境被破壞,許多空間轉(zhuǎn)錄組學(xué)和所有單細(xì)胞測序方法使研究人員無法重新訪問樣本進(jìn)行后續(xù)分析,而且這些方法需要專門的儀器或試劑,因此成本很高。
哈佛大學(xué)威斯生物激勵工程研究所的一項(xiàng)新進(jìn)展通過一種名為“Light- seq”的DNA納米技術(shù)驅(qū)動方法克服了這些限制。Light-Seq允許研究人員用專屬于少數(shù)感興趣細(xì)胞的獨(dú)特DNA條形碼對全部RNA序列進(jìn)行“地理標(biāo)記”。這些靶細(xì)胞在顯微鏡下通過一個快速有效的光交聯(lián)過程被選擇。

圖1 Light-Seq允許用專屬于少數(shù)細(xì)胞的獨(dú)特DNA條形碼對全部RNA序列進(jìn)行標(biāo)記(圖源:[1])
在一種新的DNA納米技術(shù)的幫助下,條形碼RNA序列被翻譯成連貫的DNA鏈,然后可以從組織樣本中收集并使用NGS進(jìn)行識別。Light-Seq過程可以在相同的樣本中對不同的細(xì)胞群使用不同的條形碼進(jìn)行重復(fù),并保留原樣以供后續(xù)分析。它的性能可與單細(xì)胞測序方法相媲美,極大地拓寬了組織樣本調(diào)查的深度和范圍。
通訊作者之一、懷斯研究所核心成員Peng Yin博士說:“Light-Seq獨(dú)特的功能組合填補(bǔ)了未滿足的需求:對保存的組織中難以分離的細(xì)胞群或罕見細(xì)胞類型進(jìn)行圖像信息、空間規(guī)定、深度測序分析的能力,與它們高度細(xì)化的基因表達(dá)狀態(tài)與空間、形態(tài)和潛在疾病相關(guān)特征的一一對應(yīng),因此,它有潛力快速推進(jìn)生物醫(yī)學(xué)研究領(lǐng)域的生物發(fā)現(xiàn)過程。”
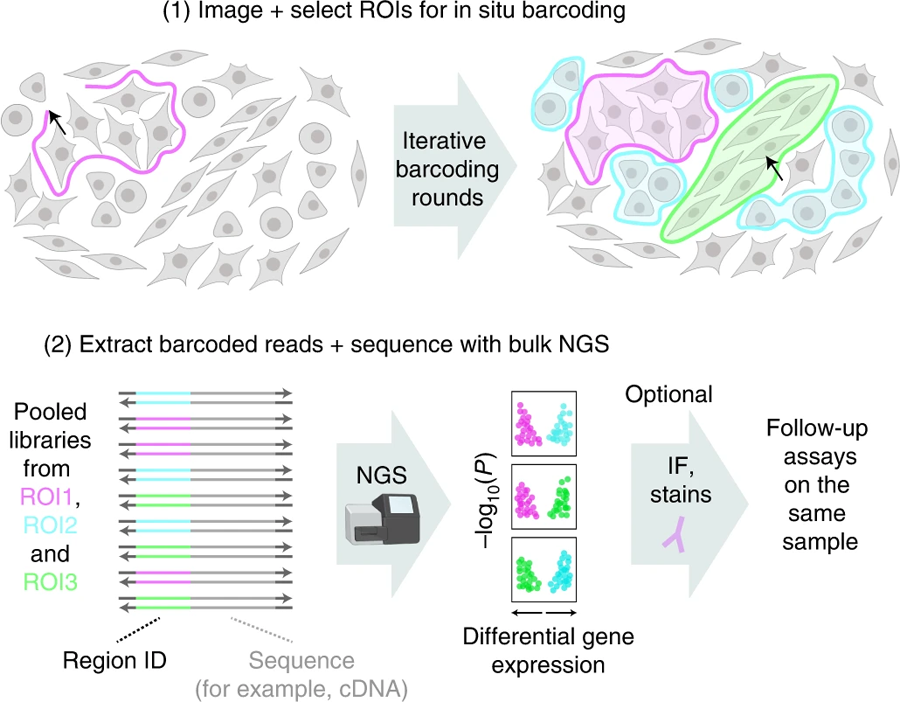
圖2 Light Seq支持對選定的細(xì)胞或組織區(qū)域原位進(jìn)行選擇性條碼用于轉(zhuǎn)錄組測序(圖源:[1])
從原位條碼到異位測序
Light-Seq項(xiàng)目是由Yin在Wyss的小組中的Jocelyn (Josie) Kishi博士、Sinem Saka博士和Ninning Liu博士以及Constance Cepko在HMS的實(shí)驗(yàn)室中的Emma West博士帶頭發(fā)起的。
在此之前,Kishi和Saka已經(jīng)開發(fā)了SABER-FISH,作為一種空間轉(zhuǎn)錄組學(xué)方法,直接在完整的組織中(原位)對基因表達(dá)進(jìn)行成像。"有了SABER-FISH,我們離捕獲細(xì)胞的完整基因表達(dá)程序仍有幾個數(shù)量級的距離,每個細(xì)胞有成千上萬的不同的RNA分子。RNA分子過于密集,無法用目前的成像技術(shù)完整地捕獲它們,"共同第一作者和共同通訊作者Kishi說。"Light-Seq通過將高分辨率的條形碼標(biāo)記與通過NGS進(jìn)行的全轉(zhuǎn)錄組測序結(jié)合起來解決了這個問題,使我們獲得了兩個世界的最好結(jié)果和額外的關(guān)鍵優(yōu)勢。" 在進(jìn)行這項(xiàng)研究時,Kishi是Yin團(tuán)隊(duì)中的一名Wyss技術(shù)發(fā)展研究員,現(xiàn)在正與她的一些合著者一起追求Light-Seq的商業(yè)化道路。
“為了在完整組織樣本的定制選擇位置對細(xì)胞進(jìn)行特定測序,我們開發(fā)了一種新的方法,將DNA條形碼光交聯(lián)到RNA分子的副本上,以及一種DNA納米技術(shù)驅(qū)動的程序,使它們及其附加的RNA序列可被NGS讀取。”共同第一作者Liu說,他是Yin團(tuán)隊(duì)的博士后,之前曾與人合作開發(fā)了一個名為“Action-PAINT”的超分辨率成像方法的并行DNA條形碼平臺,該平臺也成為了Light-Seq的核心組件之一。
首先,DNA引物與細(xì)胞中的RNA分子“堿基對”,并被擴(kuò)展以創(chuàng)建稱為互補(bǔ)DNA序列(cdna)的RNA序列副本。然后,含有超快光交聯(lián)子核苷酸的DNA條形碼鏈依次與細(xì)胞中的cdna進(jìn)行堿基配對。當(dāng)靶細(xì)胞在顯微鏡下通過一種類似模板的光學(xué)裝置被照亮?xí)r,這些細(xì)胞就會永久連接在一起,這種光學(xué)裝置將顯微鏡下的其他非靶細(xì)胞置于黑暗中,從而使它們免受光交聯(lián)反應(yīng)的影響。在洗掉那些沒有永久連接的細(xì)胞中的條形碼DNA序列之后原位,這個過程可以用不同的條形碼和光線模式重復(fù),以標(biāo)記更多感興趣的區(qū)域。
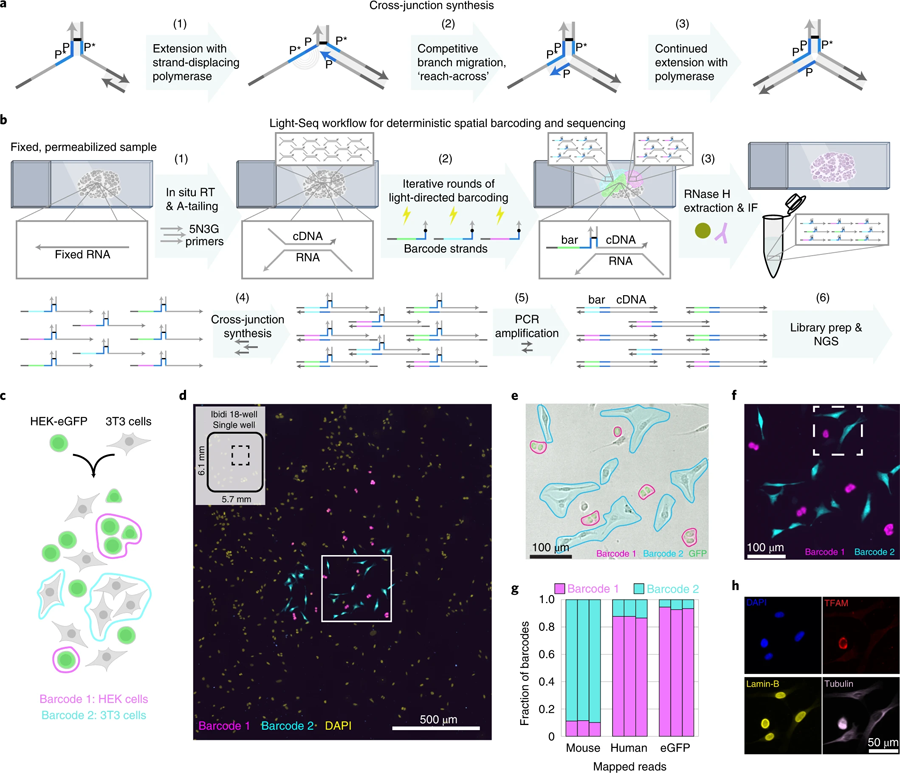
圖3 交聯(lián)合成和結(jié)合細(xì)胞混合物驗(yàn)證的全原位協(xié)議。(圖源:[1])
“為了能夠?qū)⑦@種條形碼工作流程與NGS集成,我們設(shè)計(jì)了一種基于DNA納米技術(shù)的新的拼接反應(yīng)。這項(xiàng)創(chuàng)新使我們能夠?qū)⑽覀兊臈l形碼cdna轉(zhuǎn)換成連續(xù)的讀出序列。然后我們可以從樣本中提取含有條形碼的cDNA序列的完整集合,并用標(biāo)準(zhǔn)的NGS技術(shù)分析它們,最終,每個條形碼都將完整的轉(zhuǎn)錄組讀數(shù)追溯到組織樣本中預(yù)先選擇的細(xì)胞,這些細(xì)胞保持完整,以供后續(xù)分析。這為我們提供了一個獨(dú)特的機(jī)會,在測序驗(yàn)證或進(jìn)一步探索后重新訪問完全相同的細(xì)胞。
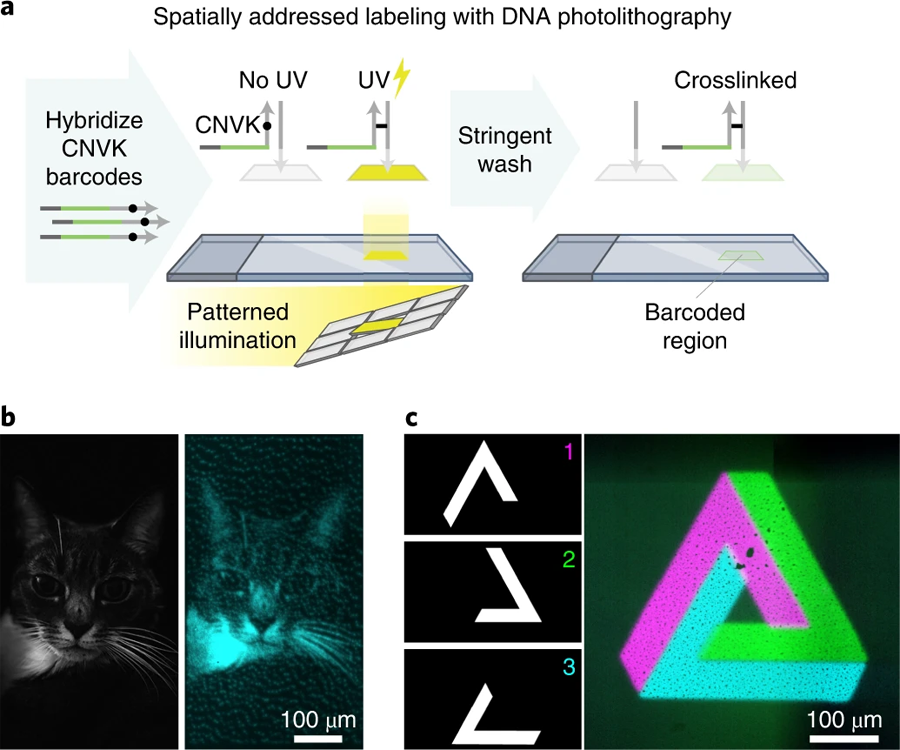
圖4 通過DNA光交聯(lián)進(jìn)行空間定位標(biāo)記(圖源:[1])
a 生物素標(biāo)記的單鏈DNA寡核苷酸通過生物素-鏈霉親和素結(jié)合固定在玻璃表面。
觀察復(fù)雜組織和稀有細(xì)胞
隨著Light-Seq在培養(yǎng)細(xì)胞中的首次驗(yàn)證,Yin的團(tuán)隊(duì)想要將其應(yīng)用到復(fù)雜的組織中,并與HMS的Constance Cepko博士團(tuán)隊(duì)合作。Cepko是該研究的通訊作者之一,他研究了視網(wǎng)膜作為神經(jīng)系統(tǒng)模型的發(fā)展。Kishi, Saka和Liu與Cepko團(tuán)隊(duì)的West合作,將Light-Seq應(yīng)用于小鼠視網(wǎng)膜的橫截面,并分析具有不同功能的三個主要層。研究人員達(dá)到了與單細(xì)胞測序方法相當(dāng)?shù)男蛄懈采w范圍,并發(fā)現(xiàn)視網(wǎng)膜的三個主要層之間富集了數(shù)千個rna。他們還表明,在序列提取后,組織樣本保持完整,并可以進(jìn)一步成像的蛋白質(zhì)和其他生物分子。
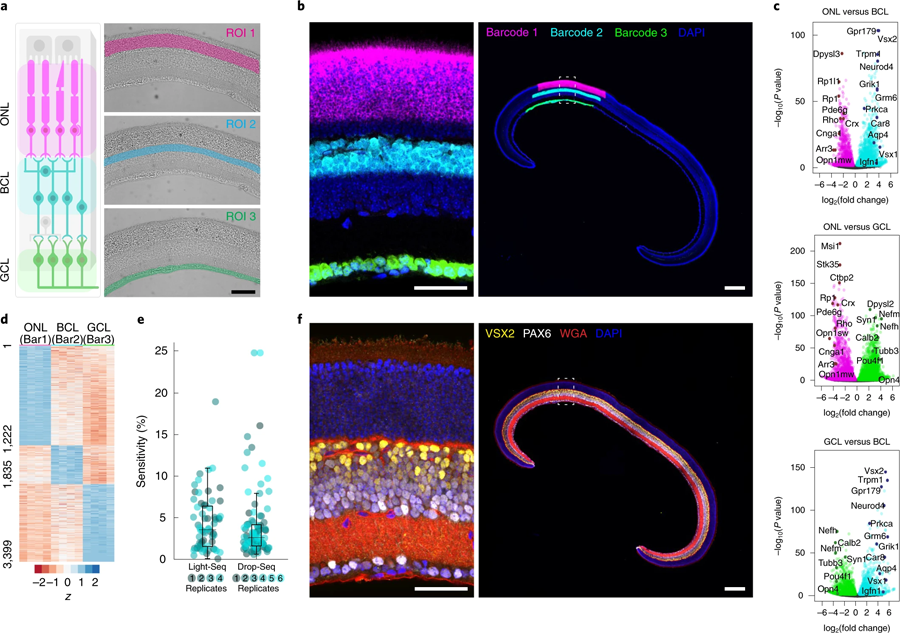
圖5 Light Seq技術(shù)應(yīng)用于小鼠冷凍視網(wǎng)膜固定區(qū)域的三個主要視網(wǎng)膜層的空間條碼編碼。(圖源:[1])
West說:“將Light-Seq發(fā)揮到極致,我們能夠分離出一種非常罕見的細(xì)胞類型的完整轉(zhuǎn)錄組,這種細(xì)胞被稱為‘多巴胺能無分泌細(xì)胞’(dac),由于它與視網(wǎng)膜中其他細(xì)胞的復(fù)雜連接,很難分離,每個橫截面只提取4到8個獨(dú)立的條形碼細(xì)胞。”dac參與調(diào)節(jié)眼睛的晝夜節(jié)律,通過微調(diào)晝夜周期中不同光照的視覺感知。West補(bǔ)充說:“Light-Seq還檢測到在低水平下特異表達(dá)在dac中的rna,以及幾十種dac特異性的生物標(biāo)志物rna,據(jù)我們所知,這為研究這種罕見的細(xì)胞類型打開了新的機(jī)會。”West在進(jìn)行這項(xiàng)研究時是Cepko的研究生,然后是博士后,現(xiàn)在已經(jīng)加入了Kishi的Light-Seq商業(yè)化努力。
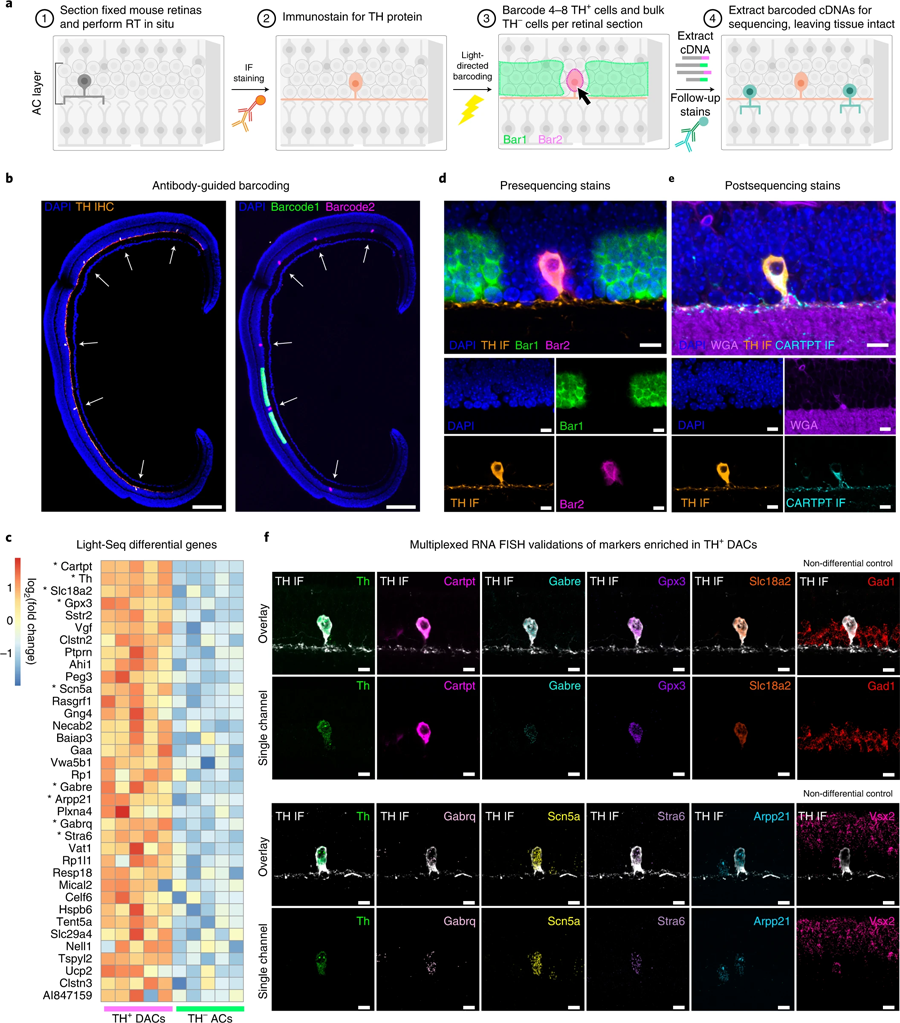
圖6 Light Seq用于稀有細(xì)胞轉(zhuǎn)錄組學(xué)(圖源:[1])
將空間轉(zhuǎn)錄組學(xué)領(lǐng)域向NGS開放,也增加了單個RNA物種水平的信息。“我們的測序數(shù)據(jù)清楚地表明,Light-Seq可以確定rna結(jié)構(gòu)的自然變化。展望未來,我們對使用Light-Seq更好地了解免疫系統(tǒng)、疾病傳播細(xì)胞和不同治療策略(如基因和細(xì)胞治療)之間的相互作用非常感興趣。”Kishi說。
“由Peng Yin的團(tuán)隊(duì)在Wyss研究所的分子機(jī)器人計(jì)劃中開發(fā)的Light-Seq技術(shù)再次表明,追求完全非傳統(tǒng)的方法和利用合成生物學(xué)可以導(dǎo)致一種具有巨大潛力的顛覆性技術(shù),促進(jìn)基礎(chǔ)研究和臨床醫(yī)學(xué)的發(fā)展。”
參考資料:
[1] Light-Seq: Light-directed in situ barcoding of biomolecules in fixed cells and tissues for spatially indexed sequencing
摘要:哈佛大學(xué)威斯生物激勵工程研究所的一項(xiàng)新進(jìn)展克服了目前在空間轉(zhuǎn)錄組學(xué)方面的局限性,采用了一種名為“Light-Seq”的DNA納米技術(shù)驅(qū)動方法。Light-Seq允許研究人員用專屬于少數(shù)感興趣細(xì)胞的獨(dú)特DNA條形碼對全部RNA序列進(jìn)行“地理標(biāo)記”。
在顯微鏡下,研究人員經(jīng)常觀察到不同類型的細(xì)胞在組織中以獨(dú)特的模式自我組織,或者有時一種罕見的細(xì)胞類型通過占據(jù)獨(dú)特的位置、顯示出不尋常的形狀或表達(dá)特定的生物標(biāo)記分子而脫穎而出。為了確定他們觀察到的更深層次的意義,他們開發(fā)了一種方法,通過分析細(xì)胞中存在的基因來源的RNA分子來訪問細(xì)胞的基因表達(dá)模式(轉(zhuǎn)錄組),他們可以將其與細(xì)胞的形狀、空間位置和分子生物標(biāo)記進(jìn)行匹配。
然而,這些“空間轉(zhuǎn)錄組學(xué)”方法仍然只能捕獲細(xì)胞總RNA分子的一小部分,不能提供單細(xì)胞測序方法提供的深度和質(zhì)量分析,單細(xì)胞測序方法是為了研究從組織或生物液體中分離出來的單個細(xì)胞的轉(zhuǎn)錄組而開發(fā)的通過下一代測序(NGS)技術(shù)。它們也不允許研究人員僅根據(jù)細(xì)胞在組織中的位置鎖定特定細(xì)胞,這將極大地促進(jìn)研究分離的細(xì)胞群,或罕見的、難以分離的細(xì)胞,如具有獨(dú)特功能的罕見腦細(xì)胞,或入侵腫瘤的免疫細(xì)胞。此外,由于原始組織環(huán)境被破壞,許多空間轉(zhuǎn)錄組學(xué)和所有單細(xì)胞測序方法使研究人員無法重新訪問樣本進(jìn)行后續(xù)分析,而且這些方法需要專門的儀器或試劑,因此成本很高。
哈佛大學(xué)威斯生物激勵工程研究所的一項(xiàng)新進(jìn)展通過一種名為“Light- seq”的DNA納米技術(shù)驅(qū)動方法克服了這些限制。Light-Seq允許研究人員用專屬于少數(shù)感興趣細(xì)胞的獨(dú)特DNA條形碼對全部RNA序列進(jìn)行“地理標(biāo)記”。這些靶細(xì)胞在顯微鏡下通過一個快速有效的光交聯(lián)過程被選擇。

圖1 Light-Seq允許用專屬于少數(shù)細(xì)胞的獨(dú)特DNA條形碼對全部RNA序列進(jìn)行標(biāo)記(圖源:[1])
在一種新的DNA納米技術(shù)的幫助下,條形碼RNA序列被翻譯成連貫的DNA鏈,然后可以從組織樣本中收集并使用NGS進(jìn)行識別。Light-Seq過程可以在相同的樣本中對不同的細(xì)胞群使用不同的條形碼進(jìn)行重復(fù),并保留原樣以供后續(xù)分析。它的性能可與單細(xì)胞測序方法相媲美,極大地拓寬了組織樣本調(diào)查的深度和范圍。
通訊作者之一、懷斯研究所核心成員Peng Yin博士說:“Light-Seq獨(dú)特的功能組合填補(bǔ)了未滿足的需求:對保存的組織中難以分離的細(xì)胞群或罕見細(xì)胞類型進(jìn)行圖像信息、空間規(guī)定、深度測序分析的能力,與它們高度細(xì)化的基因表達(dá)狀態(tài)與空間、形態(tài)和潛在疾病相關(guān)特征的一一對應(yīng),因此,它有潛力快速推進(jìn)生物醫(yī)學(xué)研究領(lǐng)域的生物發(fā)現(xiàn)過程。”

圖2 Light Seq支持對選定的細(xì)胞或組織區(qū)域原位進(jìn)行選擇性條碼用于轉(zhuǎn)錄組測序(圖源:[1])
從原位條碼到異位測序
Light-Seq項(xiàng)目是由Yin在Wyss的小組中的Jocelyn (Josie) Kishi博士、Sinem Saka博士和Ninning Liu博士以及Constance Cepko在HMS的實(shí)驗(yàn)室中的Emma West博士帶頭發(fā)起的。
在此之前,Kishi和Saka已經(jīng)開發(fā)了SABER-FISH,作為一種空間轉(zhuǎn)錄組學(xué)方法,直接在完整的組織中(原位)對基因表達(dá)進(jìn)行成像。"有了SABER-FISH,我們離捕獲細(xì)胞的完整基因表達(dá)程序仍有幾個數(shù)量級的距離,每個細(xì)胞有成千上萬的不同的RNA分子。RNA分子過于密集,無法用目前的成像技術(shù)完整地捕獲它們,"共同第一作者和共同通訊作者Kishi說。"Light-Seq通過將高分辨率的條形碼標(biāo)記與通過NGS進(jìn)行的全轉(zhuǎn)錄組測序結(jié)合起來解決了這個問題,使我們獲得了兩個世界的最好結(jié)果和額外的關(guān)鍵優(yōu)勢。" 在進(jìn)行這項(xiàng)研究時,Kishi是Yin團(tuán)隊(duì)中的一名Wyss技術(shù)發(fā)展研究員,現(xiàn)在正與她的一些合著者一起追求Light-Seq的商業(yè)化道路。
“為了在完整組織樣本的定制選擇位置對細(xì)胞進(jìn)行特定測序,我們開發(fā)了一種新的方法,將DNA條形碼光交聯(lián)到RNA分子的副本上,以及一種DNA納米技術(shù)驅(qū)動的程序,使它們及其附加的RNA序列可被NGS讀取。”共同第一作者Liu說,他是Yin團(tuán)隊(duì)的博士后,之前曾與人合作開發(fā)了一個名為“Action-PAINT”的超分辨率成像方法的并行DNA條形碼平臺,該平臺也成為了Light-Seq的核心組件之一。
首先,DNA引物與細(xì)胞中的RNA分子“堿基對”,并被擴(kuò)展以創(chuàng)建稱為互補(bǔ)DNA序列(cdna)的RNA序列副本。然后,含有超快光交聯(lián)子核苷酸的DNA條形碼鏈依次與細(xì)胞中的cdna進(jìn)行堿基配對。當(dāng)靶細(xì)胞在顯微鏡下通過一種類似模板的光學(xué)裝置被照亮?xí)r,這些細(xì)胞就會永久連接在一起,這種光學(xué)裝置將顯微鏡下的其他非靶細(xì)胞置于黑暗中,從而使它們免受光交聯(lián)反應(yīng)的影響。在洗掉那些沒有永久連接的細(xì)胞中的條形碼DNA序列之后原位,這個過程可以用不同的條形碼和光線模式重復(fù),以標(biāo)記更多感興趣的區(qū)域。

圖3 交聯(lián)合成和結(jié)合細(xì)胞混合物驗(yàn)證的全原位協(xié)議。(圖源:[1])
“為了能夠?qū)⑦@種條形碼工作流程與NGS集成,我們設(shè)計(jì)了一種基于DNA納米技術(shù)的新的拼接反應(yīng)。這項(xiàng)創(chuàng)新使我們能夠?qū)⑽覀兊臈l形碼cdna轉(zhuǎn)換成連續(xù)的讀出序列。然后我們可以從樣本中提取含有條形碼的cDNA序列的完整集合,并用標(biāo)準(zhǔn)的NGS技術(shù)分析它們,最終,每個條形碼都將完整的轉(zhuǎn)錄組讀數(shù)追溯到組織樣本中預(yù)先選擇的細(xì)胞,這些細(xì)胞保持完整,以供后續(xù)分析。這為我們提供了一個獨(dú)特的機(jī)會,在測序驗(yàn)證或進(jìn)一步探索后重新訪問完全相同的細(xì)胞。

圖4 通過DNA光交聯(lián)進(jìn)行空間定位標(biāo)記(圖源:[1])
a 生物素標(biāo)記的單鏈DNA寡核苷酸通過生物素-鏈霉親和素結(jié)合固定在玻璃表面。
觀察復(fù)雜組織和稀有細(xì)胞
隨著Light-Seq在培養(yǎng)細(xì)胞中的首次驗(yàn)證,Yin的團(tuán)隊(duì)想要將其應(yīng)用到復(fù)雜的組織中,并與HMS的Constance Cepko博士團(tuán)隊(duì)合作。Cepko是該研究的通訊作者之一,他研究了視網(wǎng)膜作為神經(jīng)系統(tǒng)模型的發(fā)展。Kishi, Saka和Liu與Cepko團(tuán)隊(duì)的West合作,將Light-Seq應(yīng)用于小鼠視網(wǎng)膜的橫截面,并分析具有不同功能的三個主要層。研究人員達(dá)到了與單細(xì)胞測序方法相當(dāng)?shù)男蛄懈采w范圍,并發(fā)現(xiàn)視網(wǎng)膜的三個主要層之間富集了數(shù)千個rna。他們還表明,在序列提取后,組織樣本保持完整,并可以進(jìn)一步成像的蛋白質(zhì)和其他生物分子。

圖5 Light Seq技術(shù)應(yīng)用于小鼠冷凍視網(wǎng)膜固定區(qū)域的三個主要視網(wǎng)膜層的空間條碼編碼。(圖源:[1])
West說:“將Light-Seq發(fā)揮到極致,我們能夠分離出一種非常罕見的細(xì)胞類型的完整轉(zhuǎn)錄組,這種細(xì)胞被稱為‘多巴胺能無分泌細(xì)胞’(dac),由于它與視網(wǎng)膜中其他細(xì)胞的復(fù)雜連接,很難分離,每個橫截面只提取4到8個獨(dú)立的條形碼細(xì)胞。”dac參與調(diào)節(jié)眼睛的晝夜節(jié)律,通過微調(diào)晝夜周期中不同光照的視覺感知。West補(bǔ)充說:“Light-Seq還檢測到在低水平下特異表達(dá)在dac中的rna,以及幾十種dac特異性的生物標(biāo)志物rna,據(jù)我們所知,這為研究這種罕見的細(xì)胞類型打開了新的機(jī)會。”West在進(jìn)行這項(xiàng)研究時是Cepko的研究生,然后是博士后,現(xiàn)在已經(jīng)加入了Kishi的Light-Seq商業(yè)化努力。

圖6 Light Seq用于稀有細(xì)胞轉(zhuǎn)錄組學(xué)(圖源:[1])
將空間轉(zhuǎn)錄組學(xué)領(lǐng)域向NGS開放,也增加了單個RNA物種水平的信息。“我們的測序數(shù)據(jù)清楚地表明,Light-Seq可以確定rna結(jié)構(gòu)的自然變化。展望未來,我們對使用Light-Seq更好地了解免疫系統(tǒng)、疾病傳播細(xì)胞和不同治療策略(如基因和細(xì)胞治療)之間的相互作用非常感興趣。”Kishi說。
“由Peng Yin的團(tuán)隊(duì)在Wyss研究所的分子機(jī)器人計(jì)劃中開發(fā)的Light-Seq技術(shù)再次表明,追求完全非傳統(tǒng)的方法和利用合成生物學(xué)可以導(dǎo)致一種具有巨大潛力的顛覆性技術(shù),促進(jìn)基礎(chǔ)研究和臨床醫(yī)學(xué)的發(fā)展。”
參考資料:
[1] Light-Seq: Light-directed in situ barcoding of biomolecules in fixed cells and tissues for spatially indexed sequencing



