摘要:科學家們創建了一個模型來研究RNA剪接缺陷在阿爾茨海默病中的作用,揭示了神經元過度興奮引起的退化和毒性。
幾十年來,研究人員一直對神經退行性疾病阿爾茨海默病(Alzheimer’s disease)感到困惑,但阻止或逆轉該疾病對大腦影響的治療方法仍然難以找到。圣裘德兒童研究醫院(St. Jude Children’s Research Hospital)的科學家們最近為這一難題增添了重要的一環,他們創造了一種比以往模型更接近人類疾病的小鼠模型。研究結果發表在今天的《Nature Aging》雜志上。

圖1 科學家們創建了一個模型來研究RNA剪接缺陷在阿爾茨海默病中的作用(圖源:[1])
研究人員使用他們的新模型來發現RNA剪接缺陷是如何導致阿爾茨海默病的神經退行性變的。RNA剪接是一種去除非編碼基因序列并將蛋白質編碼序列連接在一起的過程。
“RNA剪接是轉錄和翻譯之間的重要步驟,”通訊作者Junmin Peng博士說。“這在大腦中尤為重要,因為我們知道大腦的細胞多樣性比身體其他任何器官都要多,而剪接被認為是產生蛋白質多樣性的重要過程。”
Peng和其他人之前的工作揭示了RNA剪接機制的一個特殊成分,稱為U1小核核糖核蛋白(snRNP),在阿爾茨海默癥患者的大腦中產生聚集物。U1 snRNP復合體在RNA剪接中是必不可少的。
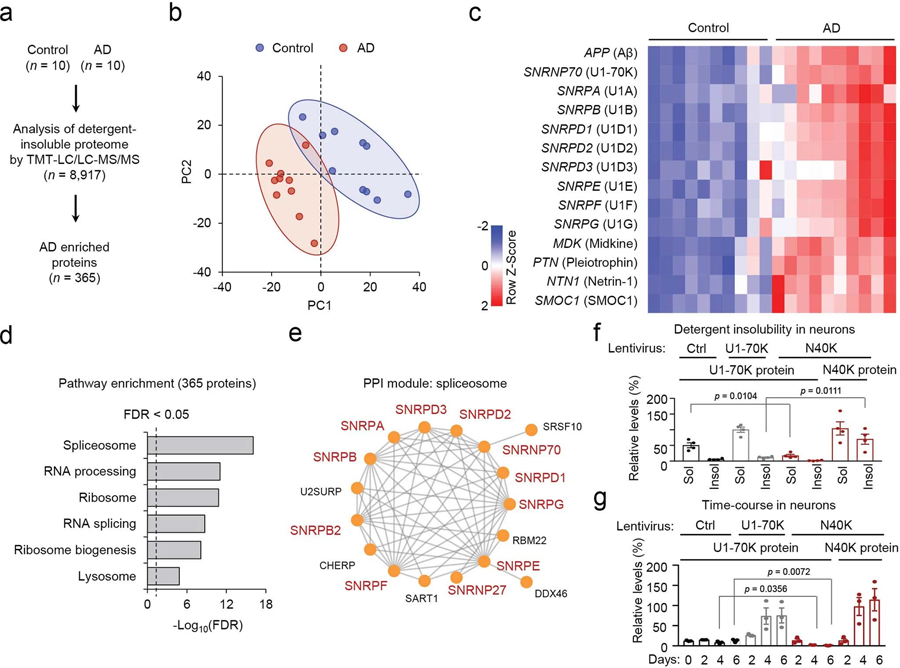
圖2 對AD小鼠中不溶蛋白質進行串聯質譜標記(TMT)圖像分析和定量免疫印跡分析
現在,Peng和他的團隊已經證明了U1 snRNP的功能障礙有助于神經退行性變,為阿爾茨海默癥的治療開辟了新的研究途徑。研究發現,由于U1 snRNP病理導致的RNA剪接功能障礙有助于導致神經退行性變。
Peng說:“我們之前的工作表明,U1 snRNP是大腦中形成纏結狀結構的一種聚集體,但這只是描述性的,直到現在我們才了解這種病理與疾病表型之間的聯系機制。”
獨特的模型將RNA剪接缺陷與神經元超興奮性聯系起來
研究人員創建了一種名為N40K-Tg的RNA拼接缺陷小鼠模型。當科學家們解除對剪接機制的控制時,他們觀察到了基本的神經退行性變,但他們想了解為什么會這樣。
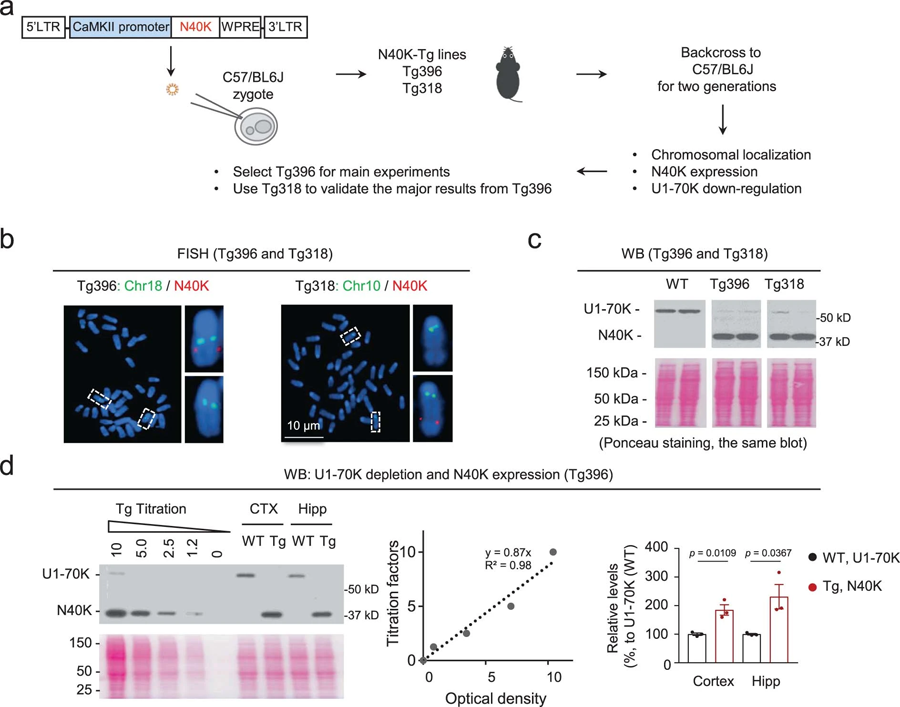
圖3 具N40K表達和U1-70K下調的N40K Tg系小鼠的多代傳代
Peng說:“拼接機械是如此重要,在實驗室中創建一個模型來研究它是一個真正的挑戰。我們能夠創建一個只發生在神經元中的拼接功能障礙模型。這個模型證明了剪接功能障礙會導致神經元毒性和認知障礙。”
抑制神經元活動可以防止大腦過度興奮。如果抑制神經元的活性被抑制,神經元會變得更加活躍,但它會引起毒性。研究人員發現,新小鼠模型中的突觸蛋白受到了顯著影響,特別是與抑制神經元活動有關的蛋白質。
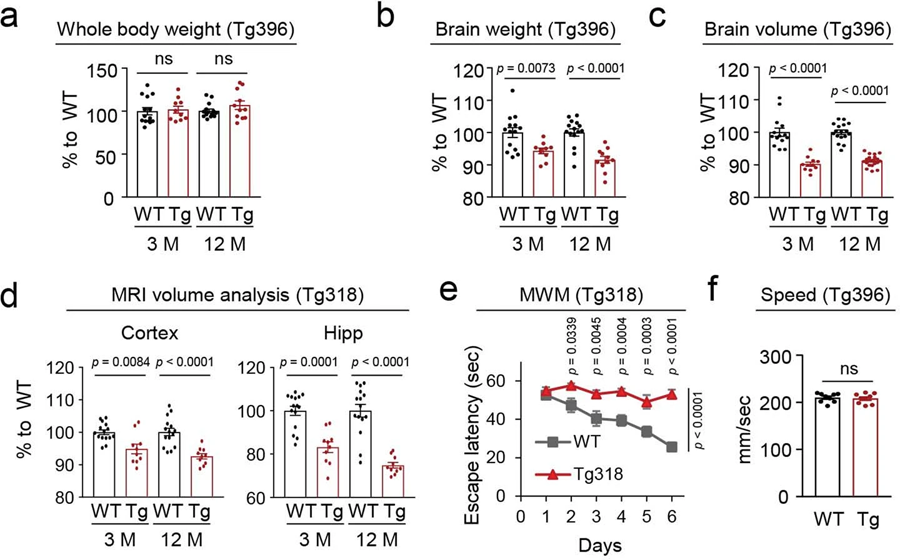
圖4 N40K-Tg小鼠表現出腦重量減輕和腦容量減少,但運動能力正常
“興奮性毒性非常重要,因為在阿爾茨海默病領域已經知道了,”Peng說。“甚至在20-30年前,人們就認識到神經元變得超級興奮,現在我們發現,剪接機制可能是導致阿爾茨海默癥患者興奮性毒性的原因。”
RNA剪接缺陷和β-淀粉樣蛋白聚集結合
阿爾茨海默病的一個標志是大腦中β-淀粉樣蛋白和tau蛋白的聚集。Peng之前的工作揭示了U1 snRNP在大腦中也會形成聚集物,但科學家們無法研究U1 snRNP功能在疾病中的作用,直到他們開發了一個干擾U1 snRNP功能導致RNA拼接缺陷的模型。
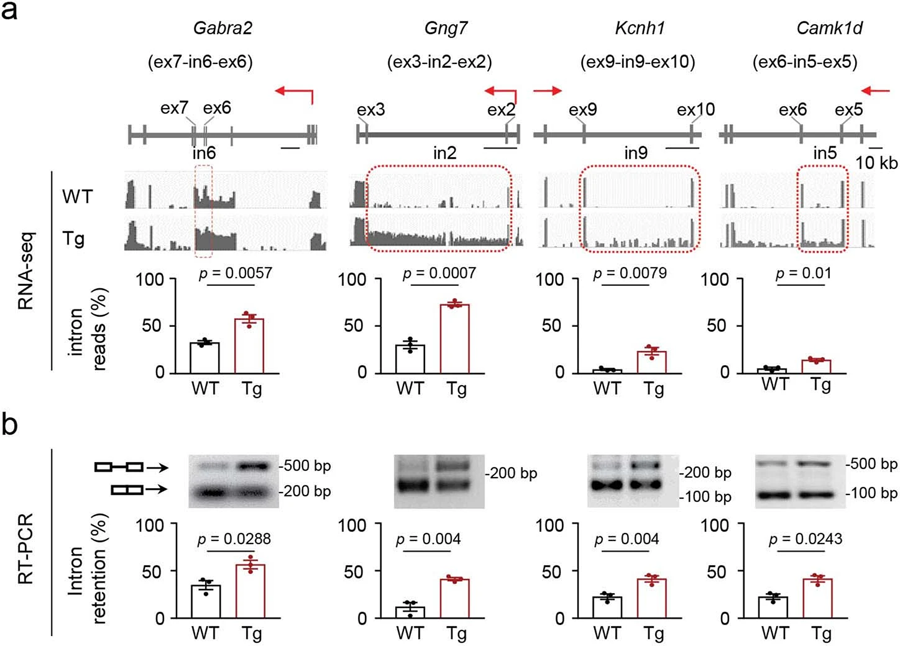
圖5 N40K-Tg小鼠突觸通路剪接缺陷轉錄的驗證
為了了解RNA剪接缺陷在β-淀粉樣蛋白聚集情況下的行為,研究人員將他們的小鼠模型與β-淀粉樣蛋白模型交叉。這兩種類型的毒性攻擊一起重塑了大腦的轉錄組和蛋白質組,解除了對突觸蛋白質的調控,加速了認知能力的下降。
Peng說:“從最初的行為到細胞生物學,再到現在的分子機制,我們已經描述了RNA剪接機制對阿爾茨海默病神經元興奮性毒性的潛在貢獻。”這個交叉小鼠模型比早期的模型更接近人類的阿爾茨海默癥,可能對未來的疾病研究有用。
參考資料:
[1] Alzheimer's disease-associated U1 snRNP splicing dysfunction causes neuronal hyperexcitability and cognitive impairment. Nature Aging, 2022; DOI: 10.1038/s43587-022-00290-0
摘要:科學家們創建了一個模型來研究RNA剪接缺陷在阿爾茨海默病中的作用,揭示了神經元過度興奮引起的退化和毒性。
幾十年來,研究人員一直對神經退行性疾病阿爾茨海默病(Alzheimer’s disease)感到困惑,但阻止或逆轉該疾病對大腦影響的治療方法仍然難以找到。圣裘德兒童研究醫院(St. Jude Children’s Research Hospital)的科學家們最近為這一難題增添了重要的一環,他們創造了一種比以往模型更接近人類疾病的小鼠模型。研究結果發表在今天的《Nature Aging》雜志上。

圖1 科學家們創建了一個模型來研究RNA剪接缺陷在阿爾茨海默病中的作用(圖源:[1])
研究人員使用他們的新模型來發現RNA剪接缺陷是如何導致阿爾茨海默病的神經退行性變的。RNA剪接是一種去除非編碼基因序列并將蛋白質編碼序列連接在一起的過程。
“RNA剪接是轉錄和翻譯之間的重要步驟,”通訊作者Junmin Peng博士說。“這在大腦中尤為重要,因為我們知道大腦的細胞多樣性比身體其他任何器官都要多,而剪接被認為是產生蛋白質多樣性的重要過程。”
Peng和其他人之前的工作揭示了RNA剪接機制的一個特殊成分,稱為U1小核核糖核蛋白(snRNP),在阿爾茨海默癥患者的大腦中產生聚集物。U1 snRNP復合體在RNA剪接中是必不可少的。

圖2 對AD小鼠中不溶蛋白質進行串聯質譜標記(TMT)圖像分析和定量免疫印跡分析
現在,Peng和他的團隊已經證明了U1 snRNP的功能障礙有助于神經退行性變,為阿爾茨海默癥的治療開辟了新的研究途徑。研究發現,由于U1 snRNP病理導致的RNA剪接功能障礙有助于導致神經退行性變。
Peng說:“我們之前的工作表明,U1 snRNP是大腦中形成纏結狀結構的一種聚集體,但這只是描述性的,直到現在我們才了解這種病理與疾病表型之間的聯系機制。”
獨特的模型將RNA剪接缺陷與神經元超興奮性聯系起來
研究人員創建了一種名為N40K-Tg的RNA拼接缺陷小鼠模型。當科學家們解除對剪接機制的控制時,他們觀察到了基本的神經退行性變,但他們想了解為什么會這樣。

圖3 具N40K表達和U1-70K下調的N40K Tg系小鼠的多代傳代
Peng說:“拼接機械是如此重要,在實驗室中創建一個模型來研究它是一個真正的挑戰。我們能夠創建一個只發生在神經元中的拼接功能障礙模型。這個模型證明了剪接功能障礙會導致神經元毒性和認知障礙。”
抑制神經元活動可以防止大腦過度興奮。如果抑制神經元的活性被抑制,神經元會變得更加活躍,但它會引起毒性。研究人員發現,新小鼠模型中的突觸蛋白受到了顯著影響,特別是與抑制神經元活動有關的蛋白質。

圖4 N40K-Tg小鼠表現出腦重量減輕和腦容量減少,但運動能力正常
“興奮性毒性非常重要,因為在阿爾茨海默病領域已經知道了,”Peng說。“甚至在20-30年前,人們就認識到神經元變得超級興奮,現在我們發現,剪接機制可能是導致阿爾茨海默癥患者興奮性毒性的原因。”
RNA剪接缺陷和β-淀粉樣蛋白聚集結合
阿爾茨海默病的一個標志是大腦中β-淀粉樣蛋白和tau蛋白的聚集。Peng之前的工作揭示了U1 snRNP在大腦中也會形成聚集物,但科學家們無法研究U1 snRNP功能在疾病中的作用,直到他們開發了一個干擾U1 snRNP功能導致RNA拼接缺陷的模型。

圖5 N40K-Tg小鼠突觸通路剪接缺陷轉錄的驗證
為了了解RNA剪接缺陷在β-淀粉樣蛋白聚集情況下的行為,研究人員將他們的小鼠模型與β-淀粉樣蛋白模型交叉。這兩種類型的毒性攻擊一起重塑了大腦的轉錄組和蛋白質組,解除了對突觸蛋白質的調控,加速了認知能力的下降。
Peng說:“從最初的行為到細胞生物學,再到現在的分子機制,我們已經描述了RNA剪接機制對阿爾茨海默病神經元興奮性毒性的潛在貢獻。”這個交叉小鼠模型比早期的模型更接近人類的阿爾茨海默癥,可能對未來的疾病研究有用。
參考資料:
[1] Alzheimer's disease-associated U1 snRNP splicing dysfunction causes neuronal hyperexcitability and cognitive impairment. Nature Aging, 2022; DOI: 10.1038/s43587-022-00290-0



