摘要:來自弗萊堡和哈佛大學的研究人員發表了B細胞抗原受體的三維結構,對其組成有了新的認識。
B細胞表面覆蓋著抗原受體,它們用它來識別入侵的病原體,如細菌和病毒。當B細胞受體與抗原結合時,即與外來結構結合時,B細胞被激活并引發抗體的產生。抗體對我們的生存至關重要,并保護我們免受COVID-19等病原體感染帶來的嚴重疾病。疫苗具有保護作用,因為它們激活抗原受體,從而觸發免疫反應。來自美國弗萊堡大學和哈佛醫學院優秀CIBSS集群的一個國際研究團隊現在發表了一種IgM型B細胞受體的確切分子結構。他們的發現表明,B細胞表面的受體與其他受體相互作用,從而控制其信號轉導。這項研究發表在著名的《Nature》雜志上。

圖1 國際研究團隊發表了一種IgM型B細胞受體的確切分子結構(圖源:[1])
信號亞基與免疫球蛋白的聯系
B細胞抗原受體由一種結合在細胞膜上的抗體和兩種較小的蛋白質Igα和Igβ組成。一旦B細胞受體識別出病原體,這些較小的亞基就會將信號傳遞到細胞內部。弗萊堡大學生物學院的Michael Reth教授博士說:“這些信號亞基究竟是如何與免疫球蛋白相連接的,這在以前是未知的。”Michael Reth教授已經對這種受體進行了30多年的研究,并最初發現了它的信號亞基。他是CIBSS綜合生物信號研究中心卓越集群的成員,也是bbss卓越集群的聯合主任?!霸诤荛L一段時間里,我們沒有技術上的可能性來研究膜蛋白的確切結構。現在,低溫電子顯微鏡使我們能夠創建B細胞受體的高分辨率圖像,”Reth說。
在冷凍電子顯微鏡下,要研究的樣品被迅速冷卻到零下183°C。這就減少了分子的自然運動,防止了微小冰晶的形成,否則會破壞蛋白質結構。通過這種方式,它可以達到比其他電子顯微鏡方法高許多倍的分辨率。在他們目前的研究中,研究人員實現了3.3 ?ngstr?ms 的分辨率,這相當于幾個原子的寬度。為此,他們將數十萬張受體的完整圖像與缺少兩個靈活區域的截斷版本的圖像結合在一起。然后,他們利用這些數據在計算機上計算出B細胞受體的完整三維結構。
對稱的膜結合抗體只在一側結合
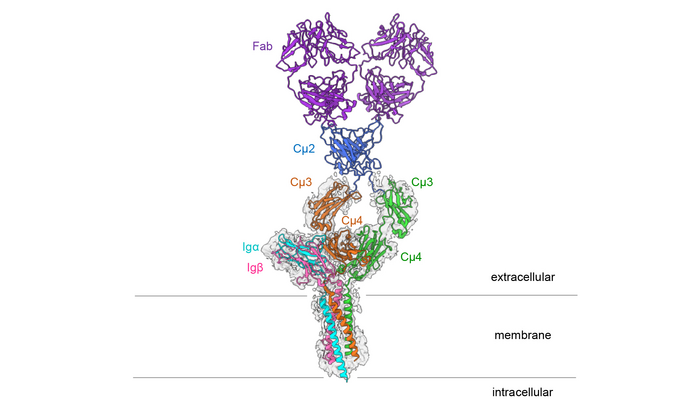
圖2 小鼠IgM B細胞受體的結構
這種三維結構的驚人之處在于,這種對稱的膜結合抗體只與一側的Ig α和Ig β結合,因此形成了一個不對稱的復合體。這種不對稱類似于T細胞受體的不對稱,T細胞受體是另一種重要的免疫受體,其結構于2019年首次闡明。Reth解釋說:“這兩種類型的抗原受體形成了不對稱的復合物,這是令人震驚的。這使我們得出結論,現在闡明的結構是一個更大的受體復合體的一部分,它與B細胞表面的其他分子相互作用?!?/div>
這種更大的結構是通過較小的力量連接在一起的,還不能用冷凍電子顯微鏡等技術進行研究。然而,最新發表的分子結構為這種與其他分子的相互作用提供了進一步的證據:它表明B細胞受體的外部包含保守的氨基酸。如果氨基酸在進化過程中幾乎不發生變化,因此在不同生物的抗原受體中是相同的,則被稱為保守氨基酸?!跋蛲舛ㄏ虻谋J匕被岬拇嬖诒砻?,IgM B細胞受體有進一步的結合伙伴,”Reth說?!皳Q句話說,到目前為止,我們只知道機器的一部分,現在我們想要識別其他的組成部分,并確定它們是如何影響受體的信號傳遞效果的?!?/div>
圖1 國際研究團隊發表了一種IgM型B細胞受體的確切分子結構(圖源:[1])
圖2 小鼠IgM B細胞受體的結構
這些其他的構建模塊可以解釋為什么受體通常保持靜止,只有當它與抗原結合時才會被激活?!斑@將是適應性免疫研究的下一個重要任務之一,”Reth總結道?!案玫亓私釨細胞激活也可以幫助我們進一步改進疫苗的開發,或了解B細胞受體以不受控制的方式激活的淋巴瘤的形成?!?/div>
參考資料:
[1] Structural principles of B-cell antigen receptor assembly
摘要:來自弗萊堡和哈佛大學的研究人員發表了B細胞抗原受體的三維結構,對其組成有了新的認識。
B細胞表面覆蓋著抗原受體,它們用它來識別入侵的病原體,如細菌和病毒。當B細胞受體與抗原結合時,即與外來結構結合時,B細胞被激活并引發抗體的產生??贵w對我們的生存至關重要,并保護我們免受COVID-19等病原體感染帶來的嚴重疾病。疫苗具有保護作用,因為它們激活抗原受體,從而觸發免疫反應。來自美國弗萊堡大學和哈佛醫學院優秀CIBSS集群的一個國際研究團隊現在發表了一種IgM型B細胞受體的確切分子結構。他們的發現表明,B細胞表面的受體與其他受體相互作用,從而控制其信號轉導。這項研究發表在著名的《Nature》雜志上。

圖1 國際研究團隊發表了一種IgM型B細胞受體的確切分子結構(圖源:[1])
信號亞基與免疫球蛋白的聯系
B細胞抗原受體由一種結合在細胞膜上的抗體和兩種較小的蛋白質Igα和Igβ組成。一旦B細胞受體識別出病原體,這些較小的亞基就會將信號傳遞到細胞內部。弗萊堡大學生物學院的Michael Reth教授博士說:“這些信號亞基究竟是如何與免疫球蛋白相連接的,這在以前是未知的。”Michael Reth教授已經對這種受體進行了30多年的研究,并最初發現了它的信號亞基。他是CIBSS綜合生物信號研究中心卓越集群的成員,也是bbss卓越集群的聯合主任。“在很長一段時間里,我們沒有技術上的可能性來研究膜蛋白的確切結構?,F在,低溫電子顯微鏡使我們能夠創建B細胞受體的高分辨率圖像,”Reth說。
在冷凍電子顯微鏡下,要研究的樣品被迅速冷卻到零下183°C。這就減少了分子的自然運動,防止了微小冰晶的形成,否則會破壞蛋白質結構。通過這種方式,它可以達到比其他電子顯微鏡方法高許多倍的分辨率。在他們目前的研究中,研究人員實現了3.3 ?ngstr?ms 的分辨率,這相當于幾個原子的寬度。為此,他們將數十萬張受體的完整圖像與缺少兩個靈活區域的截斷版本的圖像結合在一起。然后,他們利用這些數據在計算機上計算出B細胞受體的完整三維結構。
對稱的膜結合抗體只在一側結合

圖2 小鼠IgM B細胞受體的結構
這種三維結構的驚人之處在于,這種對稱的膜結合抗體只與一側的Ig α和Ig β結合,因此形成了一個不對稱的復合體。這種不對稱類似于T細胞受體的不對稱,T細胞受體是另一種重要的免疫受體,其結構于2019年首次闡明。Reth解釋說:“這兩種類型的抗原受體形成了不對稱的復合物,這是令人震驚的。這使我們得出結論,現在闡明的結構是一個更大的受體復合體的一部分,它與B細胞表面的其他分子相互作用。”
這種更大的結構是通過較小的力量連接在一起的,還不能用冷凍電子顯微鏡等技術進行研究。然而,最新發表的分子結構為這種與其他分子的相互作用提供了進一步的證據:它表明B細胞受體的外部包含保守的氨基酸。如果氨基酸在進化過程中幾乎不發生變化,因此在不同生物的抗原受體中是相同的,則被稱為保守氨基酸。“向外定向的保守氨基酸的存在表明,IgM B細胞受體有進一步的結合伙伴,”Reth說?!皳Q句話說,到目前為止,我們只知道機器的一部分,現在我們想要識別其他的組成部分,并確定它們是如何影響受體的信號傳遞效果的?!?/div>
這些其他的構建模塊可以解釋為什么受體通常保持靜止,只有當它與抗原結合時才會被激活?!斑@將是適應性免疫研究的下一個重要任務之一,”Reth總結道。“更好地了解B細胞激活也可以幫助我們進一步改進疫苗的開發,或了解B細胞受體以不受控制的方式激活的淋巴瘤的形成。”
參考資料:
[1] Structural principles of B-cell antigen receptor assembly



