摘要:該研究強調了一個基因,SPI1,作為小膠質細胞和AD風險的潛在關鍵調控因子。科學家們對導致個體易患阿爾茨海默病的基因和分子機制有了新的認識。
人類小膠質細胞是存在于大腦中的免疫細胞,西奈山的研究人員對它們的遺傳和分子機制有了前所未有的了解。這一理解可能有助于闡明它們是如何促進阿爾茨海默病(AD)的發生和發展的。這項研究最近發表在《Nature Genetics》雜志上。

圖1 人類小膠質細胞如何促進阿爾茨海默病(AD)的發生和發展的
研究人員從150名捐獻者的活體組織活檢或尸檢中收集了新鮮的人腦組織,通過這些組織,研究人員發現了21個潛在的風險基因,他們強調了其中一個,SPI1,作為小膠質細胞和AD風險的潛在關鍵調控因子。
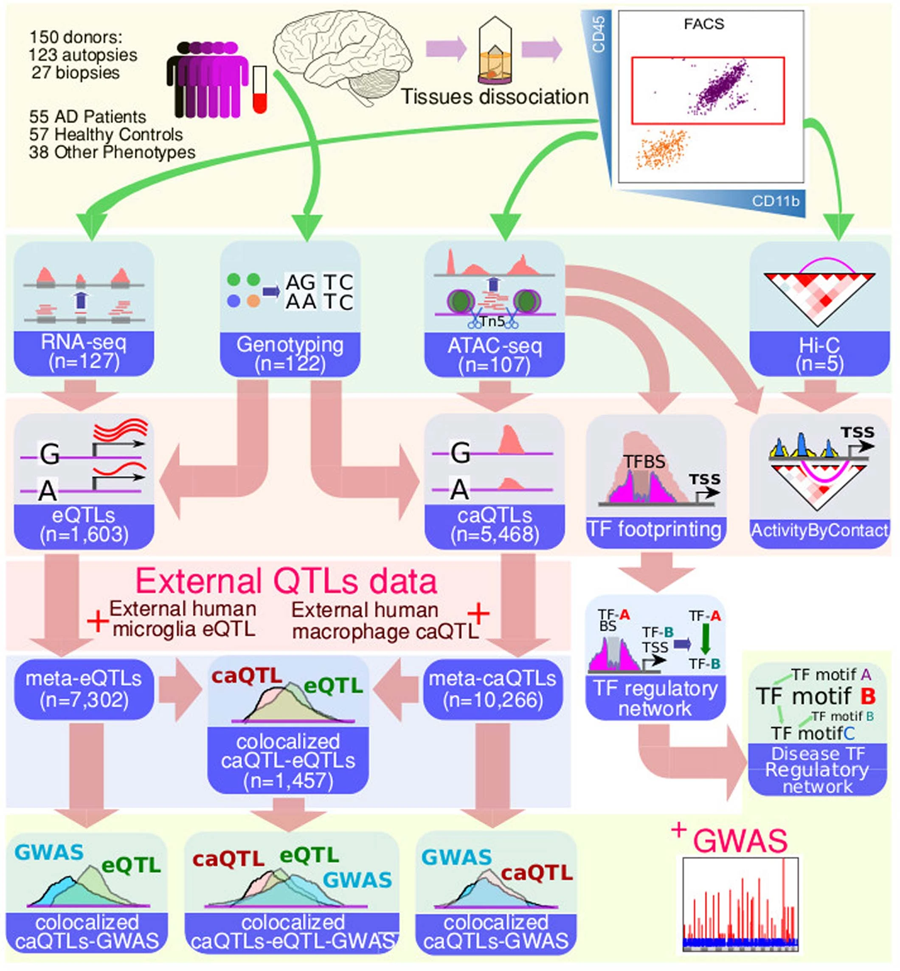
圖2 數據生成和綜合分析示意圖
西奈山伊坎醫學院精神病學、遺傳和基因組科學教授、疾病神經基因組學中心主任Panos Roussos說:“我們的研究是迄今為止對可能使人易患阿爾茨海默癥的遺傳風險因素進行的最大的人類新鮮組織小膠質細胞分析。通過更好地理解與小膠質細胞功能有關的分子和遺傳機制,我們就能更好地揭示控制這種功能和導致AD的調節機制。反過來,這些知識可以為目前沒有有效治療方法的疾病的新型治療干預鋪平道路。”
除了對神經元的發育和維持至關重要外,小膠質細胞在大腦的免疫反應中也起著重要作用。盡管之前的研究,包括一些來自西奈山的研究,已經表明小膠質細胞對阿爾茨海默病的遺傳風險和進展非常重要,但人們對這一過程背后的表觀遺傳機制知之甚少。
大多數早期的研究都是采用基于動物或細胞系的模型,這些模型不能準確地反映大腦中小膠質細胞活動的真實復雜性,因為小膠質細胞很難在人腦中分離出來。由于這些風險變量經常出現在基因組的非編碼區域(以前被稱為“垃圾DNA”),分析起來更具挑戰性,因此很難將AD的遺傳風險方差與特定的分子功能聯系起來。
西奈山團隊的解決方案是通過四家大腦生物存儲庫的合作,從活組織檢查或尸體解剖中獲取新鮮腦組織,其中三家位于西奈山,另一家來自拉什大學醫學中心/拉什阿爾茨海默病中心。Roussos博士解釋說:“從這些來源中總共使用了150個樣本,我們能夠分離出高質量的小膠質細胞,這通過反映健康和神經退行性疾病患者中小膠質細胞的一整套調控成分,為基因調控提供了前所未有的見解。”
該過程比較了AD和健康老年患者樣本的表觀遺傳、基因表達和遺傳信息,使研究人員能夠全面描述人類小膠質細胞的功能是如何被基因調節的。作為統計分析的一部分,他們擴展了先前全基因組關聯研究的發現,將已識別的AD易感基因變體與特定的DNA調控序列和已知的直接導致疾病發展的調控異常基因聯系起來。他們進一步描述了細胞范圍內的調節機制,作為一種識別涉及微膠質活動特定方面的遺傳區域的方法。
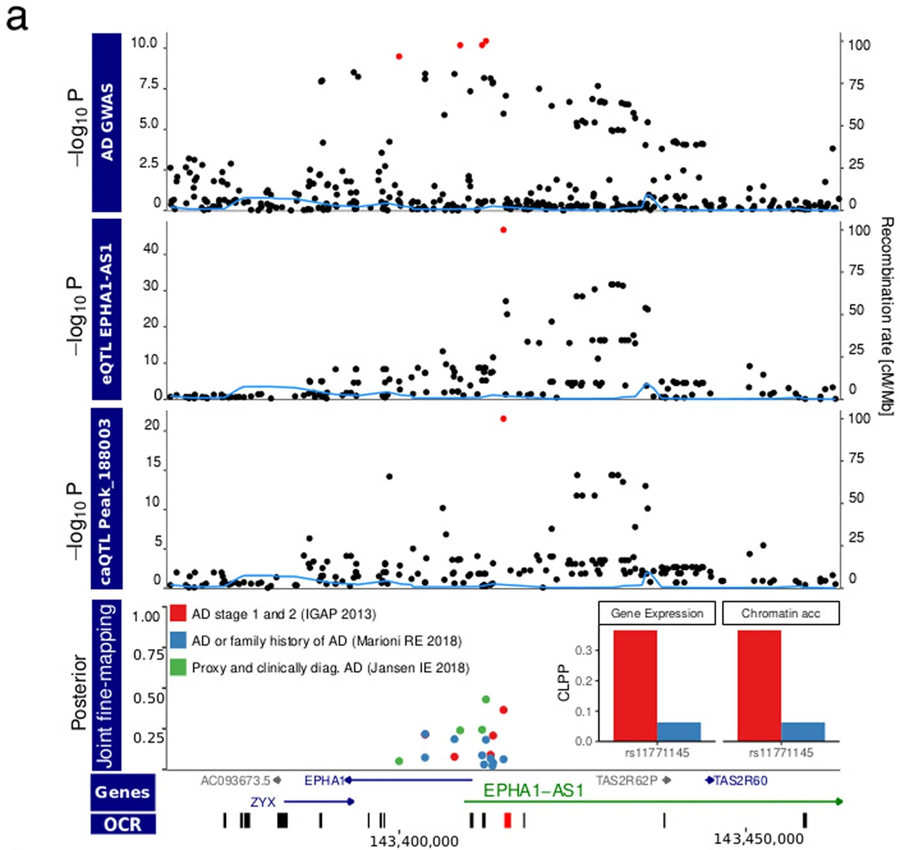
圖3 EPHA1-AS1基因調控小膠質細胞的轉錄和染色質可接觸性的AD病原學積分圖
從他們的研究中發現了關于SPI1基因的新知識,科學家們已經知道,SPI1基因是主要的小神經膠質轉錄因子,調節著與AD基因相關的其他轉錄因子和基因網絡。該團隊正在生成的數據也可能對破解其他神經退行性疾病背后的分子和遺傳奧秘很重要,這些疾病中有小膠質細胞的作用,包括帕金森病、多發性硬化癥和肌萎縮性側索硬化癥。
Roussos博士承認,他的團隊還有很多工作要做,以充分了解已識別的基因是如何促進阿爾茨海默病的發展和進展的,以及新療法如何針對這些基因。不過,他的小膠質細胞實驗室使用高度復雜的儀器進行了單細胞分析,結果讓他深受鼓舞。這些分析揭示了大腦中不同類型的免疫細胞之間與神經退行性疾病相關的獨特相互作用。“通過我們的單細胞數據,我們看到了非常令人興奮的結果,這使我們更接近于了解遺傳疾病(如阿爾茨海默癥)的基因驅動變異和細胞特異性相互作用。”
參考資料:
[1] Genetics of the human microglia regulome refines Alzheimer's disease risk loci
摘要:該研究強調了一個基因,SPI1,作為小膠質細胞和AD風險的潛在關鍵調控因子。科學家們對導致個體易患阿爾茨海默病的基因和分子機制有了新的認識。
人類小膠質細胞是存在于大腦中的免疫細胞,西奈山的研究人員對它們的遺傳和分子機制有了前所未有的了解。這一理解可能有助于闡明它們是如何促進阿爾茨海默病(AD)的發生和發展的。這項研究最近發表在《Nature Genetics》雜志上。

圖1 人類小膠質細胞如何促進阿爾茨海默病(AD)的發生和發展的
研究人員從150名捐獻者的活體組織活檢或尸檢中收集了新鮮的人腦組織,通過這些組織,研究人員發現了21個潛在的風險基因,他們強調了其中一個,SPI1,作為小膠質細胞和AD風險的潛在關鍵調控因子。

圖2 數據生成和綜合分析示意圖
西奈山伊坎醫學院精神病學、遺傳和基因組科學教授、疾病神經基因組學中心主任Panos Roussos說:“我們的研究是迄今為止對可能使人易患阿爾茨海默癥的遺傳風險因素進行的最大的人類新鮮組織小膠質細胞分析。通過更好地理解與小膠質細胞功能有關的分子和遺傳機制,我們就能更好地揭示控制這種功能和導致AD的調節機制。反過來,這些知識可以為目前沒有有效治療方法的疾病的新型治療干預鋪平道路。”
除了對神經元的發育和維持至關重要外,小膠質細胞在大腦的免疫反應中也起著重要作用。盡管之前的研究,包括一些來自西奈山的研究,已經表明小膠質細胞對阿爾茨海默病的遺傳風險和進展非常重要,但人們對這一過程背后的表觀遺傳機制知之甚少。
大多數早期的研究都是采用基于動物或細胞系的模型,這些模型不能準確地反映大腦中小膠質細胞活動的真實復雜性,因為小膠質細胞很難在人腦中分離出來。由于這些風險變量經常出現在基因組的非編碼區域(以前被稱為“垃圾DNA”),分析起來更具挑戰性,因此很難將AD的遺傳風險方差與特定的分子功能聯系起來。
西奈山團隊的解決方案是通過四家大腦生物存儲庫的合作,從活組織檢查或尸體解剖中獲取新鮮腦組織,其中三家位于西奈山,另一家來自拉什大學醫學中心/拉什阿爾茨海默病中心。Roussos博士解釋說:“從這些來源中總共使用了150個樣本,我們能夠分離出高質量的小膠質細胞,這通過反映健康和神經退行性疾病患者中小膠質細胞的一整套調控成分,為基因調控提供了前所未有的見解。”
該過程比較了AD和健康老年患者樣本的表觀遺傳、基因表達和遺傳信息,使研究人員能夠全面描述人類小膠質細胞的功能是如何被基因調節的。作為統計分析的一部分,他們擴展了先前全基因組關聯研究的發現,將已識別的AD易感基因變體與特定的DNA調控序列和已知的直接導致疾病發展的調控異常基因聯系起來。他們進一步描述了細胞范圍內的調節機制,作為一種識別涉及微膠質活動特定方面的遺傳區域的方法。

圖3 EPHA1-AS1基因調控小膠質細胞的轉錄和染色質可接觸性的AD病原學積分圖
從他們的研究中發現了關于SPI1基因的新知識,科學家們已經知道,SPI1基因是主要的小神經膠質轉錄因子,調節著與AD基因相關的其他轉錄因子和基因網絡。該團隊正在生成的數據也可能對破解其他神經退行性疾病背后的分子和遺傳奧秘很重要,這些疾病中有小膠質細胞的作用,包括帕金森病、多發性硬化癥和肌萎縮性側索硬化癥。
Roussos博士承認,他的團隊還有很多工作要做,以充分了解已識別的基因是如何促進阿爾茨海默病的發展和進展的,以及新療法如何針對這些基因。不過,他的小膠質細胞實驗室使用高度復雜的儀器進行了單細胞分析,結果讓他深受鼓舞。這些分析揭示了大腦中不同類型的免疫細胞之間與神經退行性疾病相關的獨特相互作用。“通過我們的單細胞數據,我們看到了非常令人興奮的結果,這使我們更接近于了解遺傳疾病(如阿爾茨海默癥)的基因驅動變異和細胞特異性相互作用。”
參考資料:
[1] Genetics of the human microglia regulome refines Alzheimer's disease risk loci



