摘要:MACHETE是一種基于CRISPR的新技術(shù),由斯隆凱特林研究所(SKI)的研究人員開發(fā),用于在實(shí)驗(yàn)室模型中高效地研究大規(guī)模基因缺失。
研究重點(diǎn)
MACHETE是一種新的基于crispr的技術(shù),可以在實(shí)驗(yàn)室模型中高效地研究大規(guī)模基因缺失。
使用MACHETE,研究人員發(fā)現(xiàn)一個(gè)明顯的缺失通常會(huì)消除一組干擾素基因,導(dǎo)致胰腺癌和黑色素瘤小鼠模型的預(yù)后較差。
完整的腫瘤干擾素可能是免疫治療反應(yīng)的生物標(biāo)志物。
這種技術(shù)被稱為Machete Paper。
盡管如此,斯隆·凱特琳研究所的Francisco “Pancho” Barriga和Kaloyan Tsanov不希望他們的新研究技術(shù)的名字掩蓋了他們的發(fā)現(xiàn)。他們的發(fā)現(xiàn)揭示了一種導(dǎo)致約15%癌癥的基因變化,這可能有助于識(shí)別對免疫療法有反應(yīng)的患者。
MACHETE是他們開發(fā)的基于crispr的方法,用于研究拷貝數(shù)改變(CNAs),這是癌癥中經(jīng)常發(fā)生的大規(guī)模基因變化。
MACHETE的Molecular Alteration of Chromosomes with Engineered Tandem Elements的首字母縮寫。這是一種新方法,可以切割出基因密碼的重要靶標(biāo)部分,反映癌癥和其他人類疾病中出現(xiàn)的變化。
這意味著,第一次有了一種直接有效的方法來研究實(shí)驗(yàn)室模型中的CNA缺失——比如他們研究中使用的胰腺癌和黑色素瘤小鼠模型,該研究于2022年11月7日發(fā)表在《自然·癌癥》雜志上。

圖1 使用MACHETE,研究人員發(fā)現(xiàn)一個(gè)明顯的缺失通常會(huì)消除一組干擾素基因,導(dǎo)致胰腺癌和黑色素瘤小鼠模型的預(yù)后較差(圖源:[1])
“一開始,我們甚至不想把MACHETE放在我們論文的標(biāo)題中,以更好地突出我們發(fā)現(xiàn)的重要生物學(xué)特性,”該研究所的Barriga博士說。
盡管如此,這并沒有阻止一位實(shí)驗(yàn)室伙伴在第一次展示工作成果后,將Danny Trejo的著名角色:Machete的照片貼在他的桌子上。另一位科學(xué)家也在推特上向這位演員的推特賬號(hào)發(fā)送了一份該論文的預(yù)印本。(可惜這一舉動(dòng)沒有得到回應(yīng))。
超越單基因癌癥突變
為了理解這項(xiàng)研究在人類癌癥中最常見的拷貝數(shù)改變方面的新突破,以及它對未來的病人可能意味著什么,我們需要了解基本的生物學(xué)知識(shí)。
許多人認(rèn)為癌癥的突變是基因密碼中的小“錯(cuò)別字”,它會(huì)影響單個(gè)基因的活性——要么激活它,要么關(guān)閉它。幾十年來,研究人員也主要關(guān)注這些導(dǎo)致多種癌癥的微小錯(cuò)誤。
然而,拷貝數(shù)的改變可以同時(shí)影響幾十個(gè)基因,復(fù)制或刪除單個(gè)染色體的大部分內(nèi)容。
研究人員指出,一個(gè)典型的腫瘤平均攜帶24種不同的CNAs,影響其基因組的比例高達(dá)30%。
“點(diǎn)突變相對來說比CNAs更容易研究,”Tsanov博士說,“但CNAs同樣重要——它們只是要復(fù)雜得多。”
MSK之前的研究發(fā)現(xiàn),具有較高水平的CNA(也稱為CNA負(fù)擔(dān))的腫瘤與乳腺癌、前列腺癌、子宮內(nèi)膜癌、腎透明細(xì)胞癌、甲狀腺癌和結(jié)直腸癌的復(fù)發(fā)和惡化有關(guān)。
但是,這些變化的大小和種類影響了數(shù)千甚至數(shù)百萬對DNA堿基對,而不僅僅是DNA序列中一個(gè)字母的改變,使得它們很難在實(shí)驗(yàn)室模型中重新生成以進(jìn)行深入研究。
在從實(shí)驗(yàn)室乘坐羅斯福島電車回家的途中,Barriga 博士想到了一種研究大規(guī)模基因缺失的潛在新方法。
“我想知道:‘我們怎么能選擇有預(yù)期缺失的細(xì)胞,即使它們非常罕見?’我有了一個(gè)想法,并草擬了當(dāng)晚總體策略的初步概念。我們試了一下,效果很好。在我接下來的職業(yè)生涯中,我可能永遠(yuǎn)都不會(huì)有這樣順利的事情發(fā)生。”
他開玩笑說,想出正確的單詞組合讓MACHETE這個(gè)首字母縮寫起作用花了更長的時(shí)間。
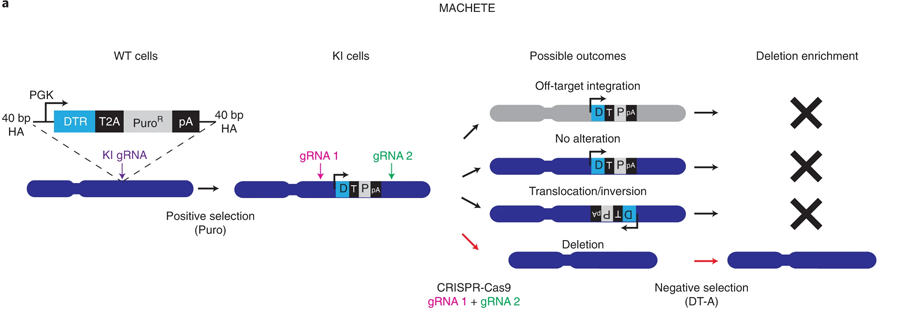
圖2 MACHETE能夠有效地工程制造出基因組缺失(圖源:[1])
但當(dāng)用MACHETE對一種患胰腺導(dǎo)管腺癌的小鼠模型進(jìn)行基因改變,結(jié)果與Tsanov博士為另一個(gè)項(xiàng)目研究的另一種小鼠模型中自然發(fā)生的類似突變產(chǎn)生的結(jié)果相同時(shí),兩人知道自己有所發(fā)現(xiàn)。
“從那時(shí)起,這真的是一次密切的合作,”Tsanov博士說。該研究團(tuán)隊(duì)還包括來自MSK、安大略癌癥研究所、紐約大學(xué)格羅斯曼醫(yī)學(xué)院和多倫多瑪格麗特公主癌癥中心的十多名其他科學(xué)家。
研究可能有助于確定哪些患者將受益于免疫治療
在將基因上被“macheted(砍掉)”的細(xì)胞插入實(shí)驗(yàn)室小鼠的胰腺后,這些小鼠患上了癌癥。基因改變?nèi)コ?號(hào)染色體的一個(gè)片段,連同它一起的是一個(gè)被稱為CDKN2A的基因,這是一種公認(rèn)的腫瘤抑制基因。正如預(yù)期的那樣,這關(guān)閉了細(xì)胞天生的阻止腫瘤細(xì)胞出現(xiàn)的能力。
這個(gè)切片還去除了一組干擾素的遺傳密碼——干擾素是一種觸發(fā)免疫細(xì)胞擊退入侵者的蛋白質(zhì),比如癌細(xì)胞——科學(xué)家們想要測試干擾素的重要性。
人類最常見的一種CNAs影響了這一染色體區(qū)域- 9p21.3,并且大約一半的患者會(huì)發(fā)展成腫瘤,其中這些干擾素也缺失。
“我們很早就知道CDKN2A突變,它們的工作方式已經(jīng)很了不起了,這項(xiàng)研究表明,它還有更多的東西,具有重要的治療意義。”
研究人員發(fā)現(xiàn),干擾素的額外損失形成了一種組合拳,使免疫系統(tǒng)中的防御者看不到腫瘤,并幫助癌癥擴(kuò)散。
“研究這些干擾素很困難,因?yàn)樗鼈冇?6個(gè)基因組成的集群編碼,使用MACHETE揭示了發(fā)展中的癌細(xì)胞避免被免疫系統(tǒng)識(shí)別的主要方式,這也可能導(dǎo)致對旨在重新激活免疫系統(tǒng)攻擊癌癥的免疫療法產(chǎn)生耐藥性。”
Lowe博士說,計(jì)算生物學(xué)家Dana Pe 'er在幫助研究團(tuán)隊(duì)了解干擾素基因的破壞是如何影響免疫細(xì)胞并幫助癌癥逃避免疫系統(tǒng)方面發(fā)揮了重要作用。
除了胰腺癌,研究結(jié)果也適用于黑色素瘤小鼠模型。
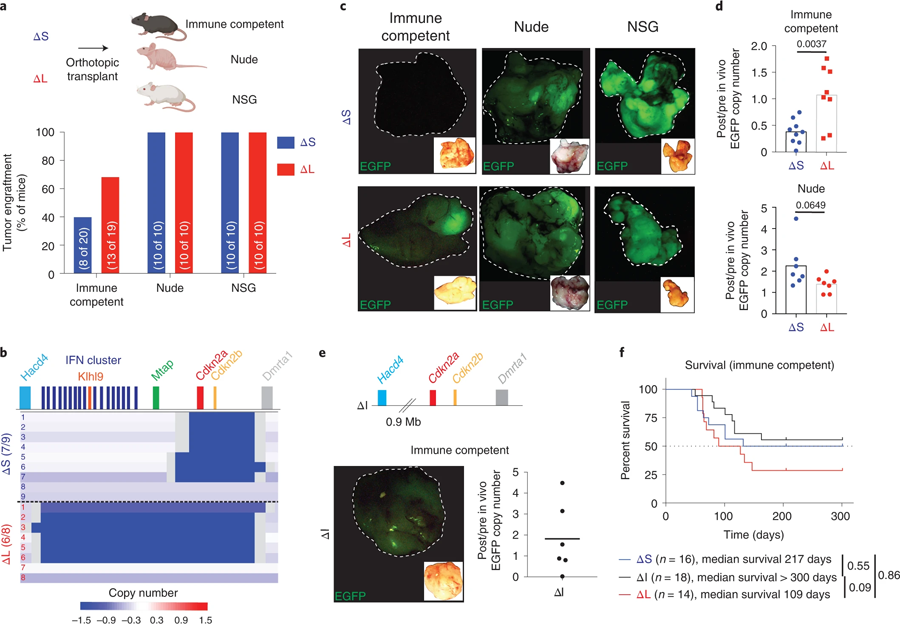
圖3 大規(guī)模4C4缺失規(guī)避了免疫編輯(圖源:[1])
研究表明,干擾素區(qū)完好無損的患者可能比干擾素區(qū)缺失的患者更適合進(jìn)行免疫治療。免疫療法可以產(chǎn)生奇效,但最大的挑戰(zhàn)之一是確定哪些患者的癌癥對免疫療法有效,哪些無效。
然而,即使是最先進(jìn)的基因組測試,如MSK-IMPACT?,通常也不會(huì)收集有關(guān)這一干擾素基因組的信息。Lowe博士指出,進(jìn)一步的研究可以表明,將其加入測序測試是否有助于識(shí)別更有可能從免疫療法中獲益的患者。
同時(shí),CNA缺失與被稱為染色體缺失綜合征的多種人類遺傳疾病有關(guān)。因此,MACHETE為研究癌癥以外的大型基因缺失事件提供了一個(gè)新的框架,”Barriga博士說。他指出,其他六個(gè)研究小組已經(jīng)在使用斯隆-凱特林研究所開發(fā)的技術(shù)。
參考資料:
[1] MACHETE identifies interferon-encompassing chromosome 9p21.3 deletions as mediators of immune evasion and metastasis
摘要:MACHETE是一種基于CRISPR的新技術(shù),由斯隆凱特林研究所(SKI)的研究人員開發(fā),用于在實(shí)驗(yàn)室模型中高效地研究大規(guī)模基因缺失。
研究重點(diǎn)
MACHETE是一種新的基于crispr的技術(shù),可以在實(shí)驗(yàn)室模型中高效地研究大規(guī)模基因缺失。
使用MACHETE,研究人員發(fā)現(xiàn)一個(gè)明顯的缺失通常會(huì)消除一組干擾素基因,導(dǎo)致胰腺癌和黑色素瘤小鼠模型的預(yù)后較差。
完整的腫瘤干擾素可能是免疫治療反應(yīng)的生物標(biāo)志物。
這種技術(shù)被稱為Machete Paper。
盡管如此,斯隆·凱特琳研究所的Francisco “Pancho” Barriga和Kaloyan Tsanov不希望他們的新研究技術(shù)的名字掩蓋了他們的發(fā)現(xiàn)。他們的發(fā)現(xiàn)揭示了一種導(dǎo)致約15%癌癥的基因變化,這可能有助于識(shí)別對免疫療法有反應(yīng)的患者。
MACHETE是他們開發(fā)的基于crispr的方法,用于研究拷貝數(shù)改變(CNAs),這是癌癥中經(jīng)常發(fā)生的大規(guī)模基因變化。
MACHETE的Molecular Alteration of Chromosomes with Engineered Tandem Elements的首字母縮寫。這是一種新方法,可以切割出基因密碼的重要靶標(biāo)部分,反映癌癥和其他人類疾病中出現(xiàn)的變化。
這意味著,第一次有了一種直接有效的方法來研究實(shí)驗(yàn)室模型中的CNA缺失——比如他們研究中使用的胰腺癌和黑色素瘤小鼠模型,該研究于2022年11月7日發(fā)表在《自然·癌癥》雜志上。

圖1 使用MACHETE,研究人員發(fā)現(xiàn)一個(gè)明顯的缺失通常會(huì)消除一組干擾素基因,導(dǎo)致胰腺癌和黑色素瘤小鼠模型的預(yù)后較差(圖源:[1])
“一開始,我們甚至不想把MACHETE放在我們論文的標(biāo)題中,以更好地突出我們發(fā)現(xiàn)的重要生物學(xué)特性,”該研究所的Barriga博士說。
盡管如此,這并沒有阻止一位實(shí)驗(yàn)室伙伴在第一次展示工作成果后,將Danny Trejo的著名角色:Machete的照片貼在他的桌子上。另一位科學(xué)家也在推特上向這位演員的推特賬號(hào)發(fā)送了一份該論文的預(yù)印本。(可惜這一舉動(dòng)沒有得到回應(yīng))。
超越單基因癌癥突變
為了理解這項(xiàng)研究在人類癌癥中最常見的拷貝數(shù)改變方面的新突破,以及它對未來的病人可能意味著什么,我們需要了解基本的生物學(xué)知識(shí)。
許多人認(rèn)為癌癥的突變是基因密碼中的小“錯(cuò)別字”,它會(huì)影響單個(gè)基因的活性——要么激活它,要么關(guān)閉它。幾十年來,研究人員也主要關(guān)注這些導(dǎo)致多種癌癥的微小錯(cuò)誤。
然而,拷貝數(shù)的改變可以同時(shí)影響幾十個(gè)基因,復(fù)制或刪除單個(gè)染色體的大部分內(nèi)容。
研究人員指出,一個(gè)典型的腫瘤平均攜帶24種不同的CNAs,影響其基因組的比例高達(dá)30%。
“點(diǎn)突變相對來說比CNAs更容易研究,”Tsanov博士說,“但CNAs同樣重要——它們只是要復(fù)雜得多。”
MSK之前的研究發(fā)現(xiàn),具有較高水平的CNA(也稱為CNA負(fù)擔(dān))的腫瘤與乳腺癌、前列腺癌、子宮內(nèi)膜癌、腎透明細(xì)胞癌、甲狀腺癌和結(jié)直腸癌的復(fù)發(fā)和惡化有關(guān)。
但是,這些變化的大小和種類影響了數(shù)千甚至數(shù)百萬對DNA堿基對,而不僅僅是DNA序列中一個(gè)字母的改變,使得它們很難在實(shí)驗(yàn)室模型中重新生成以進(jìn)行深入研究。
在從實(shí)驗(yàn)室乘坐羅斯福島電車回家的途中,Barriga 博士想到了一種研究大規(guī)模基因缺失的潛在新方法。
“我想知道:‘我們怎么能選擇有預(yù)期缺失的細(xì)胞,即使它們非常罕見?’我有了一個(gè)想法,并草擬了當(dāng)晚總體策略的初步概念。我們試了一下,效果很好。在我接下來的職業(yè)生涯中,我可能永遠(yuǎn)都不會(huì)有這樣順利的事情發(fā)生。”
他開玩笑說,想出正確的單詞組合讓MACHETE這個(gè)首字母縮寫起作用花了更長的時(shí)間。

圖2 MACHETE能夠有效地工程制造出基因組缺失(圖源:[1])
但當(dāng)用MACHETE對一種患胰腺導(dǎo)管腺癌的小鼠模型進(jìn)行基因改變,結(jié)果與Tsanov博士為另一個(gè)項(xiàng)目研究的另一種小鼠模型中自然發(fā)生的類似突變產(chǎn)生的結(jié)果相同時(shí),兩人知道自己有所發(fā)現(xiàn)。
“從那時(shí)起,這真的是一次密切的合作,”Tsanov博士說。該研究團(tuán)隊(duì)還包括來自MSK、安大略癌癥研究所、紐約大學(xué)格羅斯曼醫(yī)學(xué)院和多倫多瑪格麗特公主癌癥中心的十多名其他科學(xué)家。
研究可能有助于確定哪些患者將受益于免疫治療
在將基因上被“macheted(砍掉)”的細(xì)胞插入實(shí)驗(yàn)室小鼠的胰腺后,這些小鼠患上了癌癥。基因改變?nèi)コ?號(hào)染色體的一個(gè)片段,連同它一起的是一個(gè)被稱為CDKN2A的基因,這是一種公認(rèn)的腫瘤抑制基因。正如預(yù)期的那樣,這關(guān)閉了細(xì)胞天生的阻止腫瘤細(xì)胞出現(xiàn)的能力。
這個(gè)切片還去除了一組干擾素的遺傳密碼——干擾素是一種觸發(fā)免疫細(xì)胞擊退入侵者的蛋白質(zhì),比如癌細(xì)胞——科學(xué)家們想要測試干擾素的重要性。
人類最常見的一種CNAs影響了這一染色體區(qū)域- 9p21.3,并且大約一半的患者會(huì)發(fā)展成腫瘤,其中這些干擾素也缺失。
“我們很早就知道CDKN2A突變,它們的工作方式已經(jīng)很了不起了,這項(xiàng)研究表明,它還有更多的東西,具有重要的治療意義。”
研究人員發(fā)現(xiàn),干擾素的額外損失形成了一種組合拳,使免疫系統(tǒng)中的防御者看不到腫瘤,并幫助癌癥擴(kuò)散。
“研究這些干擾素很困難,因?yàn)樗鼈冇?6個(gè)基因組成的集群編碼,使用MACHETE揭示了發(fā)展中的癌細(xì)胞避免被免疫系統(tǒng)識(shí)別的主要方式,這也可能導(dǎo)致對旨在重新激活免疫系統(tǒng)攻擊癌癥的免疫療法產(chǎn)生耐藥性。”
Lowe博士說,計(jì)算生物學(xué)家Dana Pe 'er在幫助研究團(tuán)隊(duì)了解干擾素基因的破壞是如何影響免疫細(xì)胞并幫助癌癥逃避免疫系統(tǒng)方面發(fā)揮了重要作用。
除了胰腺癌,研究結(jié)果也適用于黑色素瘤小鼠模型。

圖3 大規(guī)模4C4缺失規(guī)避了免疫編輯(圖源:[1])
研究表明,干擾素區(qū)完好無損的患者可能比干擾素區(qū)缺失的患者更適合進(jìn)行免疫治療。免疫療法可以產(chǎn)生奇效,但最大的挑戰(zhàn)之一是確定哪些患者的癌癥對免疫療法有效,哪些無效。
然而,即使是最先進(jìn)的基因組測試,如MSK-IMPACT?,通常也不會(huì)收集有關(guān)這一干擾素基因組的信息。Lowe博士指出,進(jìn)一步的研究可以表明,將其加入測序測試是否有助于識(shí)別更有可能從免疫療法中獲益的患者。
同時(shí),CNA缺失與被稱為染色體缺失綜合征的多種人類遺傳疾病有關(guān)。因此,MACHETE為研究癌癥以外的大型基因缺失事件提供了一個(gè)新的框架,”Barriga博士說。他指出,其他六個(gè)研究小組已經(jīng)在使用斯隆-凱特林研究所開發(fā)的技術(shù)。
參考資料:
[1] MACHETE identifies interferon-encompassing chromosome 9p21.3 deletions as mediators of immune evasion and metastasis



