摘要:杜克大學健康中心的研究人員報告說,一種可能進化為幫助對抗感染的免疫反應似乎是驅使人類免疫缺陷病毒(HIV)進入潛伏狀態的機制,潛伏在細胞中,然后重新爆發。
杜克健康中心的研究人員報告稱,一種可能進化為幫助對抗感染的免疫反應似乎是驅使人類免疫缺陷病毒(HIV)進入潛伏狀態的機制,潛伏在細胞中,然后重新爆發。
該研究小組在11月14日的《自然微生物學》雜志上發表了文章,對這個令人煩惱的過程提供了新的見解,這個過程使艾滋病毒特別隱蔽,但也可能在其他病毒感染中發揮作用。

圖1 一種可能進化為幫助對抗感染的免疫反應似乎是驅使人類免疫缺陷病毒(HIV)進入潛伏狀態的機制(圖源:[1])
杜克大學醫學院分子遺傳學和微生物學系教授、資深作者Bryan R. Cullen博士說:“艾滋病毒已被證明是無法治愈的,因為有少量潛伏的艾滋病毒感染t細胞不受抗病毒藥物和免疫反應的影響。”
“這些存活時間很長的細胞可以從潛伏期中自發出現,甚至在感染數年后開始產生艾滋病毒,因此需要終生使用抗逆轉錄病毒藥物。”“盡管付出了巨大努力,但這些潛在感染細胞的來源仍然未知。”
Cullen和同事的發現提供了重要的見解,指出了一種名為SMC5/6的蛋白質復合體,它與宿主細胞的染色體功能和修復有關。
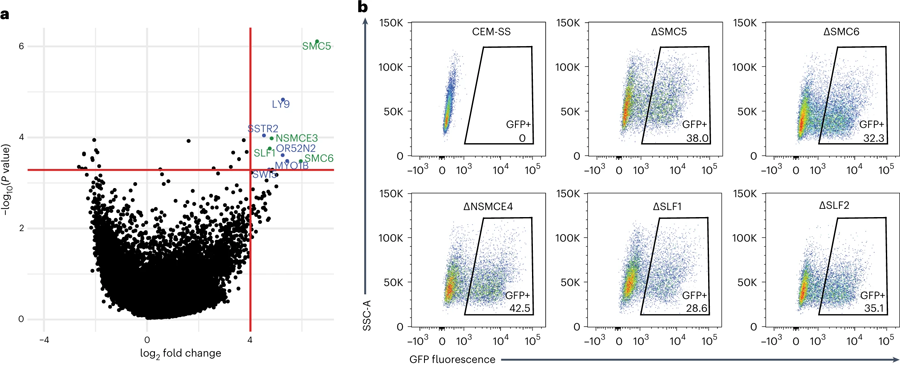
圖2 篩選確定SMC5/6在抑制潛伏的HIV-1 DNA的作用(圖源:[1])
HIV病毒進入人體,感染免疫系統的CD4+ t細胞,然后制造一個基因組長度的DNA分子,整合到宿主細胞的染色體上,然后復制產生病毒rna和蛋白質。
如果這種所謂的DNA原病毒無法融入宿主細胞的DNA,例如被一種藥物阻斷了這一過程,那么它就無法制造任何病毒rna和蛋白質,并變得惰性。相比之下,能夠整合的DNA原病毒通常能夠驅動多產的HIV感染。
Cullen和他的團隊發現,在一小部分被感染的細胞中,SMC5/6蛋白復合體啟動了一個過程,在DNA原病毒整合到宿主細胞染色體之前使其沉默。即使在整合后,這些原病毒仍保持惰性,并導致潛伏感染,潛伏在低位,直到提示爆發為活躍感染。
卡倫說:“我們的研究表明,延遲不是來自感染HIV病毒的任何內在特性,而是來自細胞固有免疫反應的不幸副作用,這種反應可能是為了抑制外來DNA的入侵而進化而來的。”
研究人員發現,一種關閉SMC5/6沉默作用的分子顯示出了作為一種潛在治療策略的良好結果,因為它抑制了潛伏的HIV感染的形成。重新激活的原病毒很容易受到自然免疫系統反應和抗逆轉錄病毒藥物的影響。
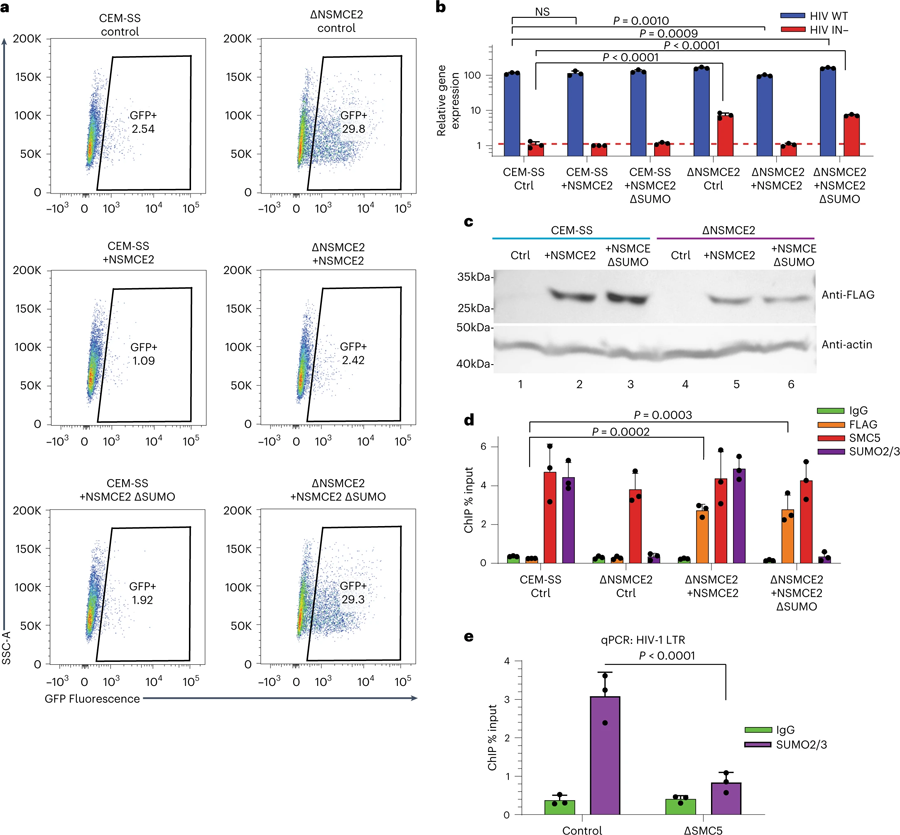
圖3 通過NSMCE2對染色質化潛伏HIV-1 DNA進行SUMO修飾(圖源:[1])
“盡管抗逆轉錄病毒療法可以將艾滋病患者體內的病毒載量降低到檢測不到的水平,但這些藥物并不能根除HIV-1。人們已經花費了大量的努力,試圖開發可以激活潛伏的HIV-1病毒的療法,并幫助抗逆轉錄病毒療法清除體內的傳染性病毒,但這一努力迄今未能找到既有效又無毒的藥物。我們的研究代表著朝著實現這一目標可能邁出的重要一步。”
Cullen說:“很明顯,了解導致HIV-1潛伏期的機制可能會讓我們了解潛伏的HIV-1原病毒是如何被重新激活然后被摧毀的。”
參考資料:
[1] Epigenetic silencing by the SMC5/6 complex mediates HIV-1 latency
摘要:杜克大學健康中心的研究人員報告說,一種可能進化為幫助對抗感染的免疫反應似乎是驅使人類免疫缺陷病毒(HIV)進入潛伏狀態的機制,潛伏在細胞中,然后重新爆發。
杜克健康中心的研究人員報告稱,一種可能進化為幫助對抗感染的免疫反應似乎是驅使人類免疫缺陷病毒(HIV)進入潛伏狀態的機制,潛伏在細胞中,然后重新爆發。
該研究小組在11月14日的《自然微生物學》雜志上發表了文章,對這個令人煩惱的過程提供了新的見解,這個過程使艾滋病毒特別隱蔽,但也可能在其他病毒感染中發揮作用。

圖1 一種可能進化為幫助對抗感染的免疫反應似乎是驅使人類免疫缺陷病毒(HIV)進入潛伏狀態的機制(圖源:[1])
杜克大學醫學院分子遺傳學和微生物學系教授、資深作者Bryan R. Cullen博士說:“艾滋病毒已被證明是無法治愈的,因為有少量潛伏的艾滋病毒感染t細胞不受抗病毒藥物和免疫反應的影響。”
“這些存活時間很長的細胞可以從潛伏期中自發出現,甚至在感染數年后開始產生艾滋病毒,因此需要終生使用抗逆轉錄病毒藥物。”“盡管付出了巨大努力,但這些潛在感染細胞的來源仍然未知。”
Cullen和同事的發現提供了重要的見解,指出了一種名為SMC5/6的蛋白質復合體,它與宿主細胞的染色體功能和修復有關。

圖2 篩選確定SMC5/6在抑制潛伏的HIV-1 DNA的作用(圖源:[1])
HIV病毒進入人體,感染免疫系統的CD4+ t細胞,然后制造一個基因組長度的DNA分子,整合到宿主細胞的染色體上,然后復制產生病毒rna和蛋白質。
如果這種所謂的DNA原病毒無法融入宿主細胞的DNA,例如被一種藥物阻斷了這一過程,那么它就無法制造任何病毒rna和蛋白質,并變得惰性。相比之下,能夠整合的DNA原病毒通常能夠驅動多產的HIV感染。
Cullen和他的團隊發現,在一小部分被感染的細胞中,SMC5/6蛋白復合體啟動了一個過程,在DNA原病毒整合到宿主細胞染色體之前使其沉默。即使在整合后,這些原病毒仍保持惰性,并導致潛伏感染,潛伏在低位,直到提示爆發為活躍感染。
卡倫說:“我們的研究表明,延遲不是來自感染HIV病毒的任何內在特性,而是來自細胞固有免疫反應的不幸副作用,這種反應可能是為了抑制外來DNA的入侵而進化而來的。”
研究人員發現,一種關閉SMC5/6沉默作用的分子顯示出了作為一種潛在治療策略的良好結果,因為它抑制了潛伏的HIV感染的形成。重新激活的原病毒很容易受到自然免疫系統反應和抗逆轉錄病毒藥物的影響。

圖3 通過NSMCE2對染色質化潛伏HIV-1 DNA進行SUMO修飾(圖源:[1])
“盡管抗逆轉錄病毒療法可以將艾滋病患者體內的病毒載量降低到檢測不到的水平,但這些藥物并不能根除HIV-1。人們已經花費了大量的努力,試圖開發可以激活潛伏的HIV-1病毒的療法,并幫助抗逆轉錄病毒療法清除體內的傳染性病毒,但這一努力迄今未能找到既有效又無毒的藥物。我們的研究代表著朝著實現這一目標可能邁出的重要一步。”
Cullen說:“很明顯,了解導致HIV-1潛伏期的機制可能會讓我們了解潛伏的HIV-1原病毒是如何被重新激活然后被摧毀的。”
參考資料:
[1] Epigenetic silencing by the SMC5/6 complex mediates HIV-1 latency



