摘要:科學(xué)家們已經(jīng)揭示了一種涉及廣泛細(xì)胞過程的關(guān)鍵蛋白質(zhì)的內(nèi)部工作原理,這可能為研制更好、毒性更小的抗癌藥物鋪平了道路。利用獲得諾貝爾獎的顯微鏡技術(shù),研究人員揭示了tankyrase蛋白是如何通過自我組裝成3D鏈狀結(jié)構(gòu)來開關(guān)自身的。
科學(xué)家們已經(jīng)揭示了一種涉及廣泛細(xì)胞過程的關(guān)鍵蛋白質(zhì)的內(nèi)部工作原理,這可能為研制更好、毒性更小的抗癌藥物鋪平了道路。
利用獲得諾貝爾獎的顯微鏡技術(shù),研究人員揭示了tankyrase蛋白是如何通過自我組裝成3D鏈狀結(jié)構(gòu)來開關(guān)自身的。
他們的研究發(fā)表在《自然》雜志上,揭示了對難以捉摸但重要的tankyrase蛋白的關(guān)鍵結(jié)構(gòu)洞察,該蛋白在幫助引發(fā)腸癌方面發(fā)揮著特別重要的作用。

圖1 科學(xué)家們已經(jīng)揭示了一種涉及廣泛細(xì)胞過程的關(guān)鍵蛋白質(zhì)的內(nèi)部工作原理(圖源:[1])
倫敦癌癥研究所的科學(xué)家們相信,他們的研究將為新型癌癥治療打開大門,這種治療方法可以比目前更精確地控制酸橙酶,而且副作用更小。
這一基本發(fā)現(xiàn)可能會對治療各種癌癥、糖尿病、炎癥、心臟和神經(jīng)退行性疾病產(chǎn)生影響。
這項研究主要由英國癌癥研究中心、惠康公司和癌癥研究所(ICR)資助,ICR本身是一個慈善機(jī)構(gòu),也是一個研究機(jī)構(gòu)。
Tankyrase是一種支持“Wnt信號”的重要蛋白質(zhì),這種信號對人體維持干細(xì)胞和進(jìn)行細(xì)胞分裂和發(fā)育等過程至關(guān)重要,但如果不受控制,可能引發(fā)腸癌等疾病。Tankyrase還控制著其他對癌癥至關(guān)重要的細(xì)胞功能,比如染色體末端端粒的維護(hù)。
與來自同一“PARP家族”的PARP1蛋白不同,tankyrase對它的了解仍然很少。雖然阻斷PARP1的藥物已經(jīng)進(jìn)入臨床,但科學(xué)家們?nèi)匀粵]有完全理解tankyrase是如何啟動的,它是如何工作的,以及如何阻斷它而不導(dǎo)致不必要的副作用。
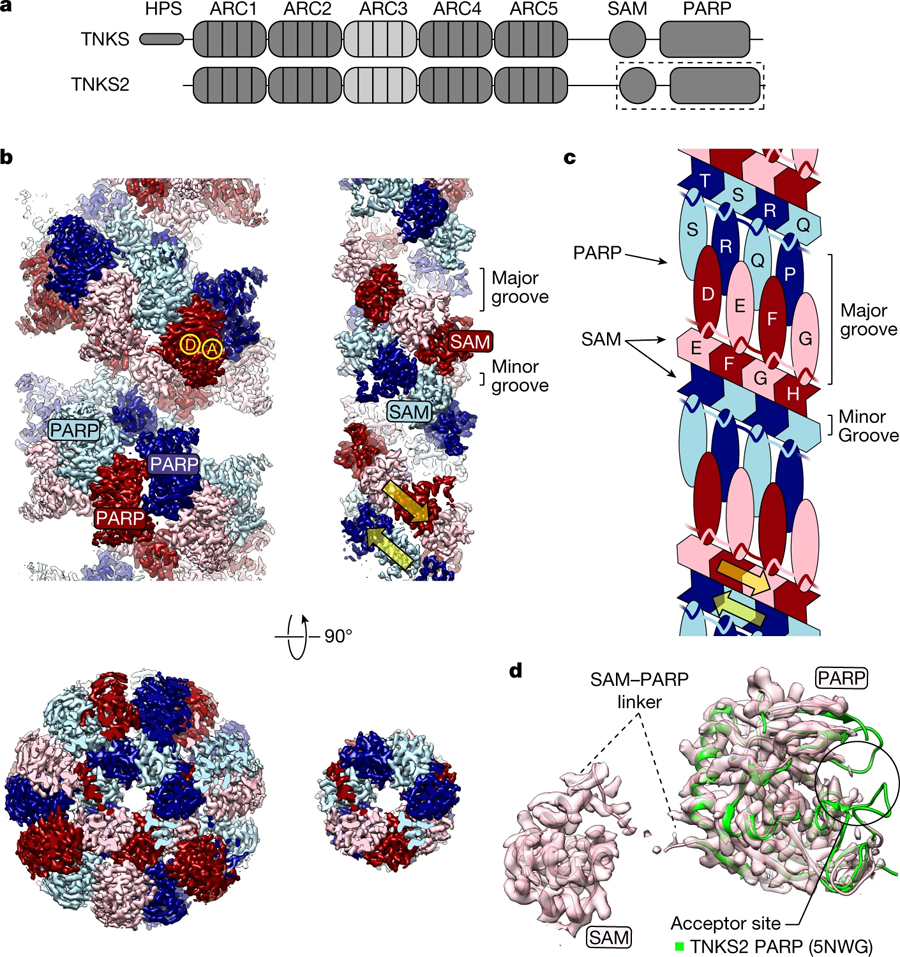
圖2 TNKS2蛋白SAM–PARP的絲狀結(jié)構(gòu)(圖源:[1])
與來自同一“PARP家族”的PARP1蛋白不同,tankyrase對它的了解仍然很少。雖然阻斷PARP1的藥物已經(jīng)進(jìn)入臨床,但科學(xué)家們?nèi)匀粵]有完全理解tankyrase是如何啟動的,它是如何工作的,以及如何阻斷它而不導(dǎo)致不必要的副作用。
在這項研究中,科學(xué)家首次將PARP1和tankyrase的激活機(jī)制進(jìn)行了比較。他們認(rèn)為,與PARP1相似,tankyrase的工作原理是被招募到一個特定的位點并“自我組裝”,聚集和改變其3D結(jié)構(gòu)來激活自己并執(zhí)行其功能。
在過去的十年里,科學(xué)家們已經(jīng)開發(fā)出阻斷tankyrase的藥物,試圖治療腸癌,但由于Wnt信號通路涉及廣泛的過程,這些藥物導(dǎo)致了太多的副作用,以致于無法進(jìn)入臨床試驗。
為了真正了解坦克酶抑制劑是如何工作的,以及如何開發(fā)毒性更小的治療方法,ICR的科學(xué)家們開始使用先進(jìn)的冷凍電子顯微鏡來發(fā)現(xiàn)新的結(jié)構(gòu)信息。這種功能極其強(qiáng)大的顯微鏡將樣品凍結(jié)在-180°C,使蛋白質(zhì)形狀的微小細(xì)節(jié)得以成像。
這種方法使他們能夠可視化并捕捉到酸橙酶是如何“自我組裝”成纖維的——鏈狀結(jié)構(gòu)——以及為什么酸橙酶需要纖維的形成來激活自己。
研究人員認(rèn)為,“結(jié)構(gòu)域”——蛋白質(zhì)中與不同功能相關(guān)的特定區(qū)域——允許酸橙酶組裝和分解成不同的結(jié)構(gòu),是未來抗癌藥物令人興奮的靶點。他們還認(rèn)為,取決于藥物結(jié)合的結(jié)構(gòu)域,不是所有的tankyrase抑制劑都會以相同的方式影響Wnt信號。
希望研究人員能夠設(shè)計出結(jié)構(gòu)不同的tankyrase抑制劑——更安全、更有效的抑制劑,這是治療腸癌和其他與tankyrase有關(guān)的疾病急需的。
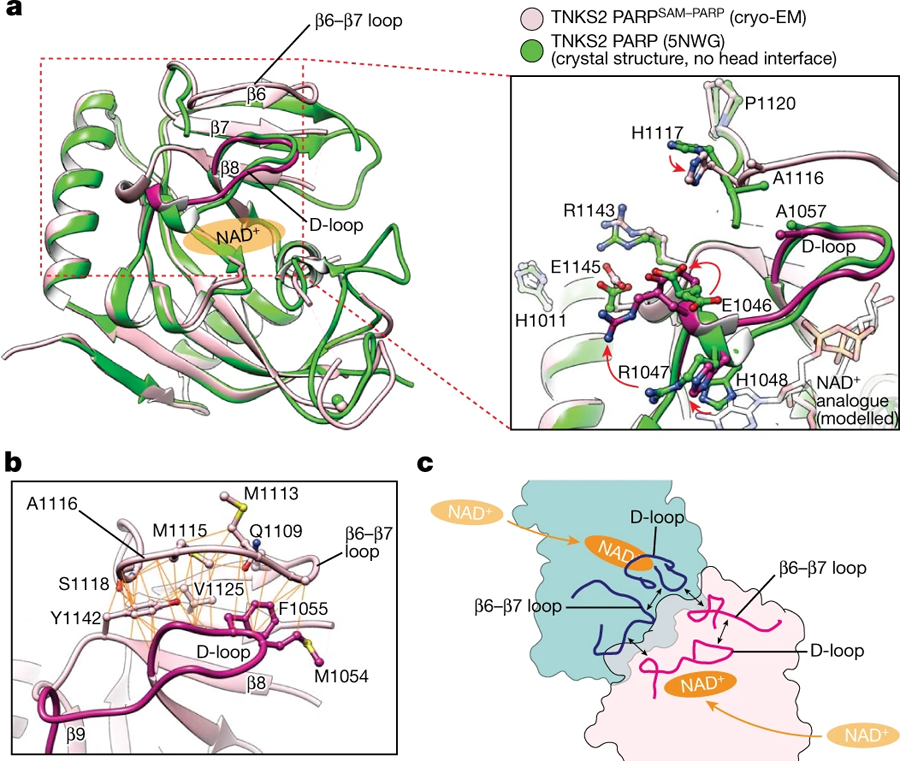
圖3 PARP–PARP頭部相互作用引起的構(gòu)象變化(圖源:[1])
研究負(fù)責(zé)人、倫敦癌癥研究所結(jié)構(gòu)生物學(xué)部門副主任塞巴斯蒂安·蓋特勒教授說:
“我們的研究為一種叫做tankyrase的特殊蛋白質(zhì)分子提供了重要的新信息,這種蛋白質(zhì)分子在腸癌和其他疾病中發(fā)揮著重要作用,但迄今為止我們一直無法理解。我們正在迎頭趕上——我們有所有這些藥物來阻止tankyrase的產(chǎn)生,但我們沒有足夠的基本知識來將它們作為治療手段。
“我們已經(jīng)展示了tankyrase是如何啟動的,并可以從一個‘懶惰的’酶變成一個活躍的酶。如果我們能創(chuàng)造出更好、毒性更小的藥物來控制這一過程,我們就可以為未來有效的腸癌治療鋪平道路。”
倫敦癌癥研究所首席執(zhí)行官克里斯蒂安·赫林教授說:
“這些基本發(fā)現(xiàn)幫助我們了解極其重要的tankyrase蛋白是如何在細(xì)胞內(nèi)工作的。幾乎所有的腸癌都有極度活躍的wnt信號,這種信號通過tankyrase起作用,因此它們有可能被靶向藥物治療。
“我希望這些在我們對tankyrase的理解上的關(guān)鍵進(jìn)展將幫助我們克服目前可用的候選藥物的限制,希望使我們更接近一種新的靶向腸癌治療方法。Tankyrase還負(fù)責(zé)調(diào)節(jié)與多種疾病相關(guān)的一系列過程,而不僅僅是癌癥,所以這項研究可能具有廣泛的意義。”
英國癌癥研究中心的研究信息經(jīng)理瑪麗安·貝克博士說:
parp可以幫助癌細(xì)胞修復(fù)受損的DNA,因此它們是抗癌藥物的關(guān)鍵靶點。我們很自豪能夠支持這項研究,它建立了對較少研究的tankyrase parp的知識,并可以幫助鋪平?的道路?在未來的新療法。
“這篇論文是一個重要發(fā)現(xiàn)研究的例子,它加深了我們對生物學(xué)的理解,這對設(shè)計新的抗癌藥物至關(guān)重要。
“這也建立在英國癌癥研究中心PARP抑制劑的成功歷史上。在20世紀(jì)90年代,由英國癌癥研究資助的ICR科學(xué)家在開發(fā)抑制PARP蛋白和阻止癌細(xì)胞自我修復(fù)的藥物?方面發(fā)揮了關(guān)鍵作用。現(xiàn)在全世界?有成千上萬的人接受這些治療。”
參考資料:
[1] Structural basis of tankyrase activation by polymerisation
摘要:科學(xué)家們已經(jīng)揭示了一種涉及廣泛細(xì)胞過程的關(guān)鍵蛋白質(zhì)的內(nèi)部工作原理,這可能為研制更好、毒性更小的抗癌藥物鋪平了道路。利用獲得諾貝爾獎的顯微鏡技術(shù),研究人員揭示了tankyrase蛋白是如何通過自我組裝成3D鏈狀結(jié)構(gòu)來開關(guān)自身的。
科學(xué)家們已經(jīng)揭示了一種涉及廣泛細(xì)胞過程的關(guān)鍵蛋白質(zhì)的內(nèi)部工作原理,這可能為研制更好、毒性更小的抗癌藥物鋪平了道路。
利用獲得諾貝爾獎的顯微鏡技術(shù),研究人員揭示了tankyrase蛋白是如何通過自我組裝成3D鏈狀結(jié)構(gòu)來開關(guān)自身的。
他們的研究發(fā)表在《自然》雜志上,揭示了對難以捉摸但重要的tankyrase蛋白的關(guān)鍵結(jié)構(gòu)洞察,該蛋白在幫助引發(fā)腸癌方面發(fā)揮著特別重要的作用。

圖1 科學(xué)家們已經(jīng)揭示了一種涉及廣泛細(xì)胞過程的關(guān)鍵蛋白質(zhì)的內(nèi)部工作原理(圖源:[1])
倫敦癌癥研究所的科學(xué)家們相信,他們的研究將為新型癌癥治療打開大門,這種治療方法可以比目前更精確地控制酸橙酶,而且副作用更小。
這一基本發(fā)現(xiàn)可能會對治療各種癌癥、糖尿病、炎癥、心臟和神經(jīng)退行性疾病產(chǎn)生影響。
這項研究主要由英國癌癥研究中心、惠康公司和癌癥研究所(ICR)資助,ICR本身是一個慈善機(jī)構(gòu),也是一個研究機(jī)構(gòu)。
Tankyrase是一種支持“Wnt信號”的重要蛋白質(zhì),這種信號對人體維持干細(xì)胞和進(jìn)行細(xì)胞分裂和發(fā)育等過程至關(guān)重要,但如果不受控制,可能引發(fā)腸癌等疾病。Tankyrase還控制著其他對癌癥至關(guān)重要的細(xì)胞功能,比如染色體末端端粒的維護(hù)。
與來自同一“PARP家族”的PARP1蛋白不同,tankyrase對它的了解仍然很少。雖然阻斷PARP1的藥物已經(jīng)進(jìn)入臨床,但科學(xué)家們?nèi)匀粵]有完全理解tankyrase是如何啟動的,它是如何工作的,以及如何阻斷它而不導(dǎo)致不必要的副作用。

圖2 TNKS2蛋白SAM–PARP的絲狀結(jié)構(gòu)(圖源:[1])
與來自同一“PARP家族”的PARP1蛋白不同,tankyrase對它的了解仍然很少。雖然阻斷PARP1的藥物已經(jīng)進(jìn)入臨床,但科學(xué)家們?nèi)匀粵]有完全理解tankyrase是如何啟動的,它是如何工作的,以及如何阻斷它而不導(dǎo)致不必要的副作用。
在這項研究中,科學(xué)家首次將PARP1和tankyrase的激活機(jī)制進(jìn)行了比較。他們認(rèn)為,與PARP1相似,tankyrase的工作原理是被招募到一個特定的位點并“自我組裝”,聚集和改變其3D結(jié)構(gòu)來激活自己并執(zhí)行其功能。
在過去的十年里,科學(xué)家們已經(jīng)開發(fā)出阻斷tankyrase的藥物,試圖治療腸癌,但由于Wnt信號通路涉及廣泛的過程,這些藥物導(dǎo)致了太多的副作用,以致于無法進(jìn)入臨床試驗。
為了真正了解坦克酶抑制劑是如何工作的,以及如何開發(fā)毒性更小的治療方法,ICR的科學(xué)家們開始使用先進(jìn)的冷凍電子顯微鏡來發(fā)現(xiàn)新的結(jié)構(gòu)信息。這種功能極其強(qiáng)大的顯微鏡將樣品凍結(jié)在-180°C,使蛋白質(zhì)形狀的微小細(xì)節(jié)得以成像。
這種方法使他們能夠可視化并捕捉到酸橙酶是如何“自我組裝”成纖維的——鏈狀結(jié)構(gòu)——以及為什么酸橙酶需要纖維的形成來激活自己。
研究人員認(rèn)為,“結(jié)構(gòu)域”——蛋白質(zhì)中與不同功能相關(guān)的特定區(qū)域——允許酸橙酶組裝和分解成不同的結(jié)構(gòu),是未來抗癌藥物令人興奮的靶點。他們還認(rèn)為,取決于藥物結(jié)合的結(jié)構(gòu)域,不是所有的tankyrase抑制劑都會以相同的方式影響Wnt信號。
希望研究人員能夠設(shè)計出結(jié)構(gòu)不同的tankyrase抑制劑——更安全、更有效的抑制劑,這是治療腸癌和其他與tankyrase有關(guān)的疾病急需的。

圖3 PARP–PARP頭部相互作用引起的構(gòu)象變化(圖源:[1])
研究負(fù)責(zé)人、倫敦癌癥研究所結(jié)構(gòu)生物學(xué)部門副主任塞巴斯蒂安·蓋特勒教授說:
“我們的研究為一種叫做tankyrase的特殊蛋白質(zhì)分子提供了重要的新信息,這種蛋白質(zhì)分子在腸癌和其他疾病中發(fā)揮著重要作用,但迄今為止我們一直無法理解。我們正在迎頭趕上——我們有所有這些藥物來阻止tankyrase的產(chǎn)生,但我們沒有足夠的基本知識來將它們作為治療手段。
“我們已經(jīng)展示了tankyrase是如何啟動的,并可以從一個‘懶惰的’酶變成一個活躍的酶。如果我們能創(chuàng)造出更好、毒性更小的藥物來控制這一過程,我們就可以為未來有效的腸癌治療鋪平道路。”
倫敦癌癥研究所首席執(zhí)行官克里斯蒂安·赫林教授說:
“這些基本發(fā)現(xiàn)幫助我們了解極其重要的tankyrase蛋白是如何在細(xì)胞內(nèi)工作的。幾乎所有的腸癌都有極度活躍的wnt信號,這種信號通過tankyrase起作用,因此它們有可能被靶向藥物治療。
“我希望這些在我們對tankyrase的理解上的關(guān)鍵進(jìn)展將幫助我們克服目前可用的候選藥物的限制,希望使我們更接近一種新的靶向腸癌治療方法。Tankyrase還負(fù)責(zé)調(diào)節(jié)與多種疾病相關(guān)的一系列過程,而不僅僅是癌癥,所以這項研究可能具有廣泛的意義。”
英國癌癥研究中心的研究信息經(jīng)理瑪麗安·貝克博士說:
parp可以幫助癌細(xì)胞修復(fù)受損的DNA,因此它們是抗癌藥物的關(guān)鍵靶點。我們很自豪能夠支持這項研究,它建立了對較少研究的tankyrase parp的知識,并可以幫助鋪平?的道路?在未來的新療法。
“這篇論文是一個重要發(fā)現(xiàn)研究的例子,它加深了我們對生物學(xué)的理解,這對設(shè)計新的抗癌藥物至關(guān)重要。
“這也建立在英國癌癥研究中心PARP抑制劑的成功歷史上。在20世紀(jì)90年代,由英國癌癥研究資助的ICR科學(xué)家在開發(fā)抑制PARP蛋白和阻止癌細(xì)胞自我修復(fù)的藥物?方面發(fā)揮了關(guān)鍵作用。現(xiàn)在全世界?有成千上萬的人接受這些治療。”
參考資料:
[1] Structural basis of tankyrase activation by polymerisation



