摘要:一項(xiàng)新的研究揭示了一種名為APOBEC3B的蛋白質(zhì)如何保護(hù)細(xì)胞免受呼吸道合胞病毒(RSV)、SARS-CoV2、流感病毒、脊髓灰質(zhì)炎病毒和麻疹等多種不同類型RNA病毒的侵害,從而幫助預(yù)防疾病。
加州大學(xué)歐文分校領(lǐng)導(dǎo)的一項(xiàng)新研究揭示了一種名為APOBEC3B的蛋白質(zhì)如何保護(hù)細(xì)胞免受呼吸道合胞病毒(RSV)、SARS-CoV2、流感病毒、脊髓灰質(zhì)炎病毒和麻疹等許多不同類型的RNA病毒的侵害,有助于預(yù)防疾病。這項(xiàng)研究發(fā)表在《Nature Communications.》雜志上。這項(xiàng)研究結(jié)果提供了對(duì)肺細(xì)胞如何保護(hù)自己免受RNA病毒感染的理解。這一新發(fā)現(xiàn)對(duì)于開發(fā)未來的治療方法以限制病毒感染和改善慢性肺部疾病患者的健康至關(guān)重要。

圖1 新研究揭示了一種名為APOBEC3B的蛋白質(zhì)如何保護(hù)細(xì)胞免受RNA病毒感染
呼吸道合胞病毒(RSV)、SARS-CoV2、流感病毒、脊髓灰質(zhì)炎病毒和麻疹——都是單鏈RNA病毒——是由呼吸道氣溶膠傳播的高傳染性疾病的一些例子,通常感染肺細(xì)胞。
“患有哮喘、囊性纖維化、慢性阻塞性肺疾病和間質(zhì)性肺疾病等慢性肺部疾病的患者更容易受到呼吸道感染。這些病毒感染可以進(jìn)一步促進(jìn)疾病進(jìn)展,”UCI醫(yī)學(xué)院生物化學(xué)系助理教授Remi Buisson博士說。“我們發(fā)現(xiàn)的一個(gè)令人興奮的部分填補(bǔ)了一個(gè)關(guān)鍵的知識(shí)空白,它闡明了APOBEC3B如何在不產(chǎn)生病毒基因組突變的情況下促進(jìn)宿主細(xì)胞的先天免疫反應(yīng),并促進(jìn)病毒進(jìn)化。”
在這項(xiàng)研究中,UCI醫(yī)學(xué)院Buisson實(shí)驗(yàn)室的研究生Lavanya Manjunath和Sunwoo Oh利用不同的RNA病毒模型,包括仙臺(tái)病毒、脊髓灰質(zhì)炎病毒和Sindbis病毒作為工具,確定APOBEC3B如何調(diào)節(jié)先天性免疫信號(hào)以應(yīng)對(duì)病毒感染。此外,他們發(fā)現(xiàn)APOBEC3B通過與PABPC1的相互作用被招募到應(yīng)激顆粒中,以防止應(yīng)激顆粒的不穩(wěn)定,并保護(hù)與應(yīng)激顆粒相關(guān)的mrna不受RNA內(nèi)切酶RNase L的影響,這種RNA內(nèi)切酶可切割宿主細(xì)胞中的RNA。
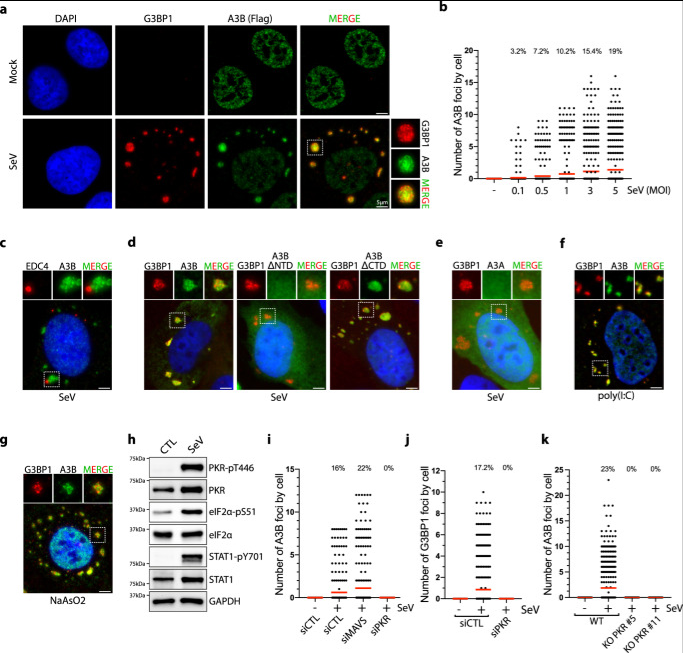
圖2 SeV感染誘導(dǎo)APOBEC3B定位于應(yīng)激顆粒
Buisson說:“我們認(rèn)為,APOBEC3B除了具有編輯病毒基因組的典型作用外,還與PABPC1一起作為重要的先天免疫媒介,在先天免疫反應(yīng)的不同步驟保護(hù)細(xì)胞免受病毒感染。”
需要更多的研究來制定預(yù)防RNA病毒感染的策略。
Buisson說:“我們的下一步是確定APOBEC3B如何識(shí)別病毒基因組以促進(jìn)先天免疫反應(yīng)并防止病毒復(fù)制的詳細(xì)機(jī)制。”“我們的目標(biāo)是確定RNA病毒是如何發(fā)展出抵抗機(jī)制來對(duì)抗APOBEC3B功能并逃避宿主細(xì)胞的防御。”
參考資料:
[1] Lavanya Manjunath, Sunwoo Oh, Pedro Ortega, Alexis Bouin, Elodie Bournique, Ambrocio Sanchez, Pia Møller Martensen, Ashley A. Auerbach, Jordan T. Becker, Marcus Seldin, Reuben S. Harris, Bert L. Semler, Rémi Buisson. APOBEC3B drives PKR-mediated translation shutdown and protects stress granules in response to viral infection. Nature Communications, 2023; 14 (1)
摘要:一項(xiàng)新的研究揭示了一種名為APOBEC3B的蛋白質(zhì)如何保護(hù)細(xì)胞免受呼吸道合胞病毒(RSV)、SARS-CoV2、流感病毒、脊髓灰質(zhì)炎病毒和麻疹等多種不同類型RNA病毒的侵害,從而幫助預(yù)防疾病。
加州大學(xué)歐文分校領(lǐng)導(dǎo)的一項(xiàng)新研究揭示了一種名為APOBEC3B的蛋白質(zhì)如何保護(hù)細(xì)胞免受呼吸道合胞病毒(RSV)、SARS-CoV2、流感病毒、脊髓灰質(zhì)炎病毒和麻疹等許多不同類型的RNA病毒的侵害,有助于預(yù)防疾病。這項(xiàng)研究發(fā)表在《Nature Communications.》雜志上。這項(xiàng)研究結(jié)果提供了對(duì)肺細(xì)胞如何保護(hù)自己免受RNA病毒感染的理解。這一新發(fā)現(xiàn)對(duì)于開發(fā)未來的治療方法以限制病毒感染和改善慢性肺部疾病患者的健康至關(guān)重要。

圖1 新研究揭示了一種名為APOBEC3B的蛋白質(zhì)如何保護(hù)細(xì)胞免受RNA病毒感染
呼吸道合胞病毒(RSV)、SARS-CoV2、流感病毒、脊髓灰質(zhì)炎病毒和麻疹——都是單鏈RNA病毒——是由呼吸道氣溶膠傳播的高傳染性疾病的一些例子,通常感染肺細(xì)胞。
“患有哮喘、囊性纖維化、慢性阻塞性肺疾病和間質(zhì)性肺疾病等慢性肺部疾病的患者更容易受到呼吸道感染。這些病毒感染可以進(jìn)一步促進(jìn)疾病進(jìn)展,”UCI醫(yī)學(xué)院生物化學(xué)系助理教授Remi Buisson博士說。“我們發(fā)現(xiàn)的一個(gè)令人興奮的部分填補(bǔ)了一個(gè)關(guān)鍵的知識(shí)空白,它闡明了APOBEC3B如何在不產(chǎn)生病毒基因組突變的情況下促進(jìn)宿主細(xì)胞的先天免疫反應(yīng),并促進(jìn)病毒進(jìn)化。”
在這項(xiàng)研究中,UCI醫(yī)學(xué)院Buisson實(shí)驗(yàn)室的研究生Lavanya Manjunath和Sunwoo Oh利用不同的RNA病毒模型,包括仙臺(tái)病毒、脊髓灰質(zhì)炎病毒和Sindbis病毒作為工具,確定APOBEC3B如何調(diào)節(jié)先天性免疫信號(hào)以應(yīng)對(duì)病毒感染。此外,他們發(fā)現(xiàn)APOBEC3B通過與PABPC1的相互作用被招募到應(yīng)激顆粒中,以防止應(yīng)激顆粒的不穩(wěn)定,并保護(hù)與應(yīng)激顆粒相關(guān)的mrna不受RNA內(nèi)切酶RNase L的影響,這種RNA內(nèi)切酶可切割宿主細(xì)胞中的RNA。

圖2 SeV感染誘導(dǎo)APOBEC3B定位于應(yīng)激顆粒
Buisson說:“我們認(rèn)為,APOBEC3B除了具有編輯病毒基因組的典型作用外,還與PABPC1一起作為重要的先天免疫媒介,在先天免疫反應(yīng)的不同步驟保護(hù)細(xì)胞免受病毒感染。”
需要更多的研究來制定預(yù)防RNA病毒感染的策略。
Buisson說:“我們的下一步是確定APOBEC3B如何識(shí)別病毒基因組以促進(jìn)先天免疫反應(yīng)并防止病毒復(fù)制的詳細(xì)機(jī)制。”“我們的目標(biāo)是確定RNA病毒是如何發(fā)展出抵抗機(jī)制來對(duì)抗APOBEC3B功能并逃避宿主細(xì)胞的防御。”
參考資料:
[1] Lavanya Manjunath, Sunwoo Oh, Pedro Ortega, Alexis Bouin, Elodie Bournique, Ambrocio Sanchez, Pia Møller Martensen, Ashley A. Auerbach, Jordan T. Becker, Marcus Seldin, Reuben S. Harris, Bert L. Semler, Rémi Buisson. APOBEC3B drives PKR-mediated translation shutdown and protects stress granules in response to viral infection. Nature Communications, 2023; 14 (1)



