摘要:一種名為CIART的基因的活性是引發(fā)COVID-19病毒感染的關(guān)鍵因素。
根據(jù)威爾康奈爾醫(yī)學(xué)院和紐約大學(xué)格羅斯曼醫(yī)學(xué)院研究人員的一項(xiàng)研究,一種名為CIART的基因的活性是引發(fā)COVID-19病毒感染的關(guān)鍵因素。
在3月13日發(fā)表在《Nature Cell Biology》雜志上的這項(xiàng)研究中,研究人員使用了多個(gè)被稱為類器官的人體組織小三維團(tuán)塊模型,來尋找影響SARS-CoV-2感染的一般宿主因素,SARS-CoV-2是導(dǎo)致COVID-19的冠狀病毒。

圖1 CIART基因的活性是引發(fā)COVID-19病毒感染的關(guān)鍵因素
他們在肺和心臟組織建模的類器官中發(fā)現(xiàn)CIART是一種強(qiáng)的SARS-CoV-使能因子。研究人員將CIART對SARS-CoV-2感染的允許作用追溯到它刺激被稱為脂肪酸的小分子的合成。
該研究的共同通訊作者Shuibing Chen教授說:“這一發(fā)現(xiàn)揭示了多器官類方法的力量,揭示了一種未來藥物可以靶向治療或預(yù)防跨多器官系統(tǒng)的SARS-CoV-2感染的途徑?!?/div>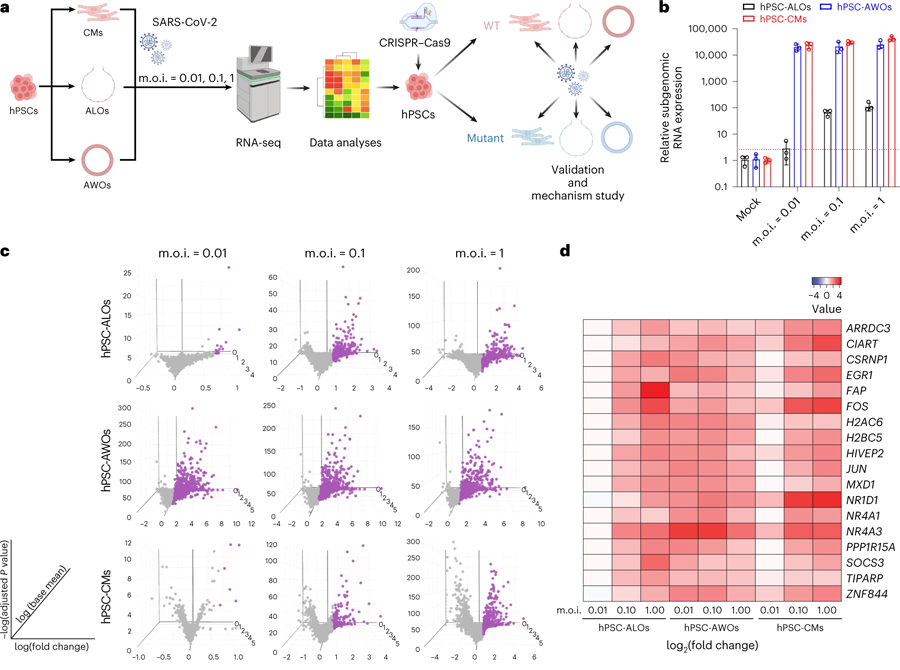
圖2 用于識別與SARS-CoV-2感染相關(guān)基因的多類器官平臺
圖1 CIART基因的活性是引發(fā)COVID-19病毒感染的關(guān)鍵因素
與其他呼吸道病毒一樣,SARS-CoV-2通常在喉嚨和鼻竇引發(fā)感染。但它經(jīng)常從呼吸道擴(kuò)散到身體的其他部位,如腸道、肝臟、心臟、腎臟、大腦、血管和胰腺。這些組織感染常見于重癥COVID-19,可導(dǎo)致致命并發(fā)癥,包括血凝塊和器官衰竭。
不同的器官對SARS-CoV-2感染的反應(yīng)往往不同。在這項(xiàng)研究中,科學(xué)家門想尋找多個(gè)器官相關(guān)的因素。研究人員從人類干細(xì)胞開始,培養(yǎng)出類器官來模擬支氣管氣道組織、肺深處的氣體交換“肺泡”組織和心肌,這些組織都可以被SARS-CoV-2感染。在紐約大學(xué)格羅斯曼分校的一個(gè)高級生物安全設(shè)施中,研究人員將這些類器官暴露于不同數(shù)量的病毒中,并確定了18個(gè)基因,這些基因在感染期間,在多個(gè)類器官和不同的病毒劑量下變得更加活躍。

圖2 用于識別與SARS-CoV-2感染相關(guān)基因的多類器官平臺
在CRISPR編輯后,T細(xì)胞被擴(kuò)增并注入實(shí)體瘤小鼠模型中,研究人員觀察到,與單獨(dú)禁用Regnase-1相比,雙重敲除導(dǎo)致至少10倍的工程T細(xì)胞,以及增加的抗腫瘤免疫活性和工程T細(xì)胞的壽命。在一些小鼠中,它還導(dǎo)致淋巴細(xì)胞產(chǎn)生過剩,導(dǎo)致毒性。
Sheppard說:“CRISPR是一種有用的工具,可以完全消除Regnase和Roquin等靶基因的表達(dá),從而產(chǎn)生明確的表型,然而,還有其他策略可以考慮將這項(xiàng)工作轉(zhuǎn)化為臨床環(huán)境,例如條件基因調(diào)控的形式。”“我們當(dāng)然對結(jié)合敲除這兩種非冗余蛋白質(zhì)所釋放的抗腫瘤效力印象深刻。在實(shí)體腫瘤研究中,我們經(jīng)??吹紺AR - T細(xì)胞的有限擴(kuò)張,但如果我們能夠使每個(gè)T細(xì)胞更有效,并大量復(fù)制它們,我們預(yù)計(jì)T細(xì)胞療法將有更好的機(jī)會攻擊實(shí)體腫瘤?!?/div>
其他作者還包括Omar Johnson, Jordan ref, Ting-Jia Fan和John Scholler。這項(xiàng)研究得到了美國國立衛(wèi)生研究院(1P01CA214278, R01CA226983)、帕克癌癥免疫治療研究所、愛默生集體、方丹獎學(xué)金、諾曼和塞爾瑪·克倫研究獎學(xué)金以及羅伯特·伍德·約翰遜基金會衛(wèi)生政策研究學(xué)者的支持。
參考資料:
[1] Combined disruption of T cell inflammatory regulators Regnase-1 and Roquin-1 enhances antitumor activity of engineered human T cells
摘要:一種名為CIART的基因的活性是引發(fā)COVID-19病毒感染的關(guān)鍵因素。
根據(jù)威爾康奈爾醫(yī)學(xué)院和紐約大學(xué)格羅斯曼醫(yī)學(xué)院研究人員的一項(xiàng)研究,一種名為CIART的基因的活性是引發(fā)COVID-19病毒感染的關(guān)鍵因素。
在3月13日發(fā)表在《Nature Cell Biology》雜志上的這項(xiàng)研究中,研究人員使用了多個(gè)被稱為類器官的人體組織小三維團(tuán)塊模型,來尋找影響SARS-CoV-2感染的一般宿主因素,SARS-CoV-2是導(dǎo)致COVID-19的冠狀病毒。

圖1 CIART基因的活性是引發(fā)COVID-19病毒感染的關(guān)鍵因素
他們在肺和心臟組織建模的類器官中發(fā)現(xiàn)CIART是一種強(qiáng)的SARS-CoV-使能因子。研究人員將CIART對SARS-CoV-2感染的允許作用追溯到它刺激被稱為脂肪酸的小分子的合成。
該研究的共同通訊作者Shuibing Chen教授說:“這一發(fā)現(xiàn)揭示了多器官類方法的力量,揭示了一種未來藥物可以靶向治療或預(yù)防跨多器官系統(tǒng)的SARS-CoV-2感染的途徑?!?/div>
圖2 用于識別與SARS-CoV-2感染相關(guān)基因的多類器官平臺
與其他呼吸道病毒一樣,SARS-CoV-2通常在喉嚨和鼻竇引發(fā)感染。但它經(jīng)常從呼吸道擴(kuò)散到身體的其他部位,如腸道、肝臟、心臟、腎臟、大腦、血管和胰腺。這些組織感染常見于重癥COVID-19,可導(dǎo)致致命并發(fā)癥,包括血凝塊和器官衰竭。
不同的器官對SARS-CoV-2感染的反應(yīng)往往不同。在這項(xiàng)研究中,科學(xué)家門想尋找多個(gè)器官相關(guān)的因素。研究人員從人類干細(xì)胞開始,培養(yǎng)出類器官來模擬支氣管氣道組織、肺深處的氣體交換“肺泡”組織和心肌,這些組織都可以被SARS-CoV-2感染。在紐約大學(xué)格羅斯曼分校的一個(gè)高級生物安全設(shè)施中,研究人員將這些類器官暴露于不同數(shù)量的病毒中,并確定了18個(gè)基因,這些基因在感染期間,在多個(gè)類器官和不同的病毒劑量下變得更加活躍。

圖2 用于識別與SARS-CoV-2感染相關(guān)基因的多類器官平臺
在CRISPR編輯后,T細(xì)胞被擴(kuò)增并注入實(shí)體瘤小鼠模型中,研究人員觀察到,與單獨(dú)禁用Regnase-1相比,雙重敲除導(dǎo)致至少10倍的工程T細(xì)胞,以及增加的抗腫瘤免疫活性和工程T細(xì)胞的壽命。在一些小鼠中,它還導(dǎo)致淋巴細(xì)胞產(chǎn)生過剩,導(dǎo)致毒性。
Sheppard說:“CRISPR是一種有用的工具,可以完全消除Regnase和Roquin等靶基因的表達(dá),從而產(chǎn)生明確的表型,然而,還有其他策略可以考慮將這項(xiàng)工作轉(zhuǎn)化為臨床環(huán)境,例如條件基因調(diào)控的形式?!薄拔覀儺?dāng)然對結(jié)合敲除這兩種非冗余蛋白質(zhì)所釋放的抗腫瘤效力印象深刻。在實(shí)體腫瘤研究中,我們經(jīng)??吹紺AR - T細(xì)胞的有限擴(kuò)張,但如果我們能夠使每個(gè)T細(xì)胞更有效,并大量復(fù)制它們,我們預(yù)計(jì)T細(xì)胞療法將有更好的機(jī)會攻擊實(shí)體腫瘤。”
其他作者還包括Omar Johnson, Jordan ref, Ting-Jia Fan和John Scholler。這項(xiàng)研究得到了美國國立衛(wèi)生研究院(1P01CA214278, R01CA226983)、帕克癌癥免疫治療研究所、愛默生集體、方丹獎學(xué)金、諾曼和塞爾瑪·克倫研究獎學(xué)金以及羅伯特·伍德·約翰遜基金會衛(wèi)生政策研究學(xué)者的支持。
參考資料:
[1] Combined disruption of T cell inflammatory regulators Regnase-1 and Roquin-1 enhances antitumor activity of engineered human T cells



