摘要:一種以前未被發現的蛋白質的功能,在細胞應激過程中對RNA修復很重要。。
核糖核酸(rna)是單鏈分子,在所有生物體的細胞中起著至關重要的作用。例如,作為我們基因的“轉錄本”,mRNA通過自己的序列攜帶制造蛋白質的指令,參與了遺傳信息的翻譯。康斯坦茨大學(University of Konstanz)有機和細胞化學教授Andreas Marx解釋說:“為了在細胞中發揮不同的功能,RNA通常需要進行化學修飾,或在受損后進行修復。”
其中起作用的一種化學反應是兩條RNA鏈在各自的兩端進行三步連接(結扎)。這種反應是由一種叫做RNA連接酶的特殊酶引發的,從病毒到真菌和植物,這種反應存在于所有形式的生命中。在包括人類在內的脊椎動物中,這種RNA連接酶尚未被發現。來自康斯坦茨的一個跨學科研究小組現在發現了這種類型的第一個人類RNA連接酶:蛋白質C12orf29。在細胞水平上,發表在《自然通訊》上的研究結果表明,這種酶具有抵抗細胞應激的保護功能。

圖1 蛋白質C12orf29具有抵抗細胞應激的保護功能
“我們在對人類肺癌和腎細胞的廣泛研究中注意到C12orf29,我們在尋找具有特定化學特征的蛋白質時使用了新的化學工具。它引起了我們的注意,因為在那之前,人們還不知道這種蛋白質的功能是什么,”因此,研究人員開發并使用了各種方案來純化和預測未開發蛋白質的結構,并進行實驗來追蹤其化學功能。因此,他們能夠證明最初只是一個合理的懷疑:C12orf29使用三磷酸腺苷(ATP)連接RNA鏈。
研究人員能夠詳細地展示這個過程遵循一個特征,從其他生命形式的其他RNA連接酶中已知的三步反應模式。為了進一步了解C12orf29在細胞水平上的功能,研究人員在闡明了化學機制后又進一步研究了C12orf29。“我們使用CRISPR/Cas基因剪刀生成了一個人類腎細胞系,其中編碼C12orf29的基因被敲除。然后,我們能夠在不同的實驗條件下將這些敲除(KO)細胞與‘正常’腎細胞進行比較,”Marx解釋說。
特別是,當用K維生素甲萘醌處理細胞時,KO細胞與具有功能性RNA連接酶的野生型細胞之間觀察到明顯的差異:相對低濃度的甲萘醌足以損傷KO細胞。相比之下,野生型細胞僅在明顯較高的濃度下受損。由于已知甲萘醌會引起氧化應激,研究人員從這一結果中得出結論,C12orf29可以防止氧化細胞應激。“我們假設以前隱藏的人類RNA修復機制是C12orf29生物學功能的基礎。我們現在需要在進一步的研究中檢驗這種機制,”Marx說。
這項研究是針對一種大腸桿菌菌株進行的,這種細菌導致了大約80%的尿路感染,也是導致敗血癥的常見原因。臨床前試驗證實了這一途徑在控制細菌感染中的作用。
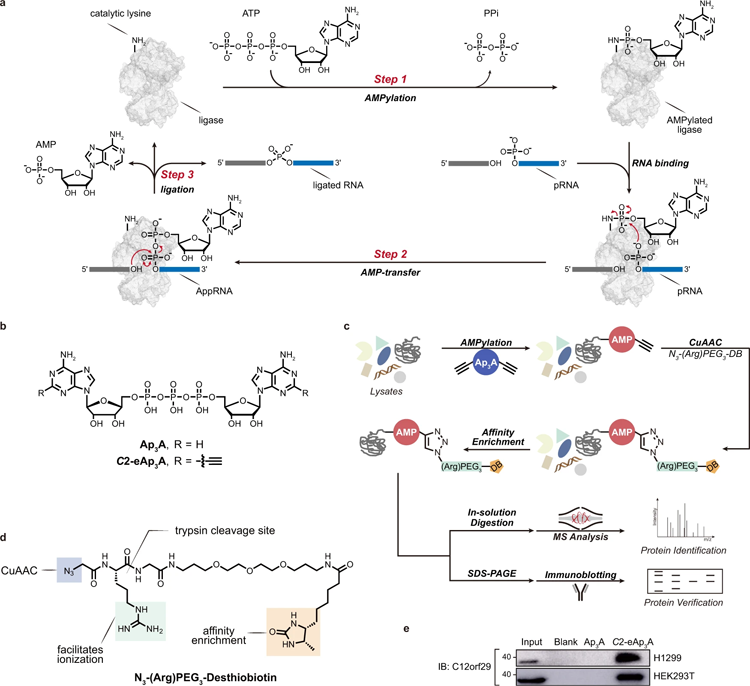
圖2 RNA連接酶機制和用修飾的Ap3A探針通過化學蛋白質組學鑒定C12orf29
研究總結:
康斯坦茨的研究人員闡明了一種以前未被表征的人類蛋白質(C12orf29)的功能。RNA連接酶催化了一種反應,這種反應以前在人類中沒有發現過。這項研究的結果表明,在人類中存在一種以前被隱藏的RNA修復機制。
康斯坦茨大學化學系和生物系不同研究團隊的跨學科合作項目
參考資料:
[1] Chemoproteomic discovery of a human RNA ligase
摘要:一種以前未被發現的蛋白質的功能,在細胞應激過程中對RNA修復很重要。。
核糖核酸(rna)是單鏈分子,在所有生物體的細胞中起著至關重要的作用。例如,作為我們基因的“轉錄本”,mRNA通過自己的序列攜帶制造蛋白質的指令,參與了遺傳信息的翻譯。康斯坦茨大學(University of Konstanz)有機和細胞化學教授Andreas Marx解釋說:“為了在細胞中發揮不同的功能,RNA通常需要進行化學修飾,或在受損后進行修復。”
其中起作用的一種化學反應是兩條RNA鏈在各自的兩端進行三步連接(結扎)。這種反應是由一種叫做RNA連接酶的特殊酶引發的,從病毒到真菌和植物,這種反應存在于所有形式的生命中。在包括人類在內的脊椎動物中,這種RNA連接酶尚未被發現。來自康斯坦茨的一個跨學科研究小組現在發現了這種類型的第一個人類RNA連接酶:蛋白質C12orf29。在細胞水平上,發表在《自然通訊》上的研究結果表明,這種酶具有抵抗細胞應激的保護功能。

圖1 蛋白質C12orf29具有抵抗細胞應激的保護功能
“我們在對人類肺癌和腎細胞的廣泛研究中注意到C12orf29,我們在尋找具有特定化學特征的蛋白質時使用了新的化學工具。它引起了我們的注意,因為在那之前,人們還不知道這種蛋白質的功能是什么,”因此,研究人員開發并使用了各種方案來純化和預測未開發蛋白質的結構,并進行實驗來追蹤其化學功能。因此,他們能夠證明最初只是一個合理的懷疑:C12orf29使用三磷酸腺苷(ATP)連接RNA鏈。
研究人員能夠詳細地展示這個過程遵循一個特征,從其他生命形式的其他RNA連接酶中已知的三步反應模式。為了進一步了解C12orf29在細胞水平上的功能,研究人員在闡明了化學機制后又進一步研究了C12orf29。“我們使用CRISPR/Cas基因剪刀生成了一個人類腎細胞系,其中編碼C12orf29的基因被敲除。然后,我們能夠在不同的實驗條件下將這些敲除(KO)細胞與‘正常’腎細胞進行比較,”Marx解釋說。
特別是,當用K維生素甲萘醌處理細胞時,KO細胞與具有功能性RNA連接酶的野生型細胞之間觀察到明顯的差異:相對低濃度的甲萘醌足以損傷KO細胞。相比之下,野生型細胞僅在明顯較高的濃度下受損。由于已知甲萘醌會引起氧化應激,研究人員從這一結果中得出結論,C12orf29可以防止氧化細胞應激。“我們假設以前隱藏的人類RNA修復機制是C12orf29生物學功能的基礎。我們現在需要在進一步的研究中檢驗這種機制,”Marx說。
這項研究是針對一種大腸桿菌菌株進行的,這種細菌導致了大約80%的尿路感染,也是導致敗血癥的常見原因。臨床前試驗證實了這一途徑在控制細菌感染中的作用。

圖2 RNA連接酶機制和用修飾的Ap3A探針通過化學蛋白質組學鑒定C12orf29
研究總結:
康斯坦茨的研究人員闡明了一種以前未被表征的人類蛋白質(C12orf29)的功能。RNA連接酶催化了一種反應,這種反應以前在人類中沒有發現過。這項研究的結果表明,在人類中存在一種以前被隱藏的RNA修復機制。
康斯坦茨大學化學系和生物系不同研究團隊的跨學科合作項目
參考資料:
[1] Chemoproteomic discovery of a human RNA ligase



