細(xì)胞質(zhì)膜是包圍在細(xì)胞表面的一層極薄的膜,也是其生存和發(fā)展的“保護(hù)傘”。即使“豪橫”如癌細(xì)胞,質(zhì)膜受損也可能會(huì)帶來(lái)毀滅性的影響。目前,細(xì)胞已經(jīng)發(fā)展出快速的修復(fù)機(jī)制來(lái)重新封閉破損的細(xì)胞膜,如果能夠了解癌細(xì)胞如何從損傷中恢復(fù)的機(jī)制,或許將為癌癥治療帶來(lái)新的突破口。
近日,來(lái)自丹麥癌癥協(xié)會(huì)研究中心、哥本哈根大學(xué)以及南丹麥大學(xué)的研究人員在Science Advances發(fā)表了一篇題為Restructuring of the plasma membrane upon damage by LC3-associated macropinocytosis的研究報(bào)告,指出癌細(xì)胞能夠通過(guò)大型胞飲作用(macropinocytosis),“吃掉”細(xì)胞受損區(qū)域從而在危急關(guān)頭存活下來(lái)。值得注意的是,研究人員還發(fā)現(xiàn)了一種獨(dú)特的膜重組機(jī)制,這為人們抑制癌細(xì)胞的擴(kuò)散、消滅腫瘤奠定了基礎(chǔ)。

DOI:10.1126/sciadv.abg1969
在進(jìn)入正題前,需要先介紹一下與細(xì)胞損傷及修復(fù)有關(guān)的細(xì)胞自噬和大型胞飲作用。自噬一種普遍存在于大部分真核細(xì)胞中的再循環(huán)系統(tǒng)(recycling system),能夠像“垃圾處理廠”一樣,將細(xì)胞內(nèi)受損的結(jié)構(gòu)轉(zhuǎn)化為養(yǎng)分被回收利用。大型胞飲作用則是通過(guò)質(zhì)膜皺縮包裹內(nèi)吞物形成大囊泡完成的一種胞吞作用。
先前的研究表明,細(xì)胞質(zhì)膜的修復(fù)機(jī)制依賴(lài)于內(nèi)吞、胞吐及膜脫落機(jī)制等生物學(xué)過(guò)程,膜聯(lián)蛋白能夠通過(guò)一系列反應(yīng)促進(jìn)細(xì)胞受損處周?chē)馁|(zhì)膜融合,從而暫時(shí)阻止細(xì)胞內(nèi)液體的流出。然而,在質(zhì)膜閉合后細(xì)胞如何重組受損質(zhì)膜,恢復(fù)細(xì)胞功能,仍然是未知數(shù)。那么,這個(gè)過(guò)程是否與細(xì)胞自噬有關(guān)呢?
為了揭開(kāi)細(xì)胞修復(fù)的背后機(jī)制,研究人員使用消融激光造成人乳腺癌細(xì)胞MCF7 細(xì)胞及宮頸癌細(xì)胞HeLa 細(xì)胞損傷,結(jié)果發(fā)現(xiàn),細(xì)胞能夠在20-30秒內(nèi)重新封閉,并且令人驚訝的是,細(xì)胞受損會(huì)造成膜褶皺,在此區(qū)域形成兩種與細(xì)胞自噬有關(guān)的蛋白質(zhì)囊泡:一種是源于質(zhì)膜受損區(qū)域、與早期內(nèi)吞作用相關(guān)的Rab5陽(yáng)性大囊泡,大約在質(zhì)膜損傷后2-5分鐘左右開(kāi)始形成;另一種是出現(xiàn)在修復(fù)區(qū)域的表達(dá)微管相關(guān)蛋白1輕鏈3(LC3,與自噬相關(guān)的蛋白質(zhì))陽(yáng)性小囊泡,在細(xì)胞受損8~10分鐘時(shí)形成。隨著時(shí)間的推移,兩種囊泡將在細(xì)胞修復(fù)區(qū)域共定位,并且似乎融合了。
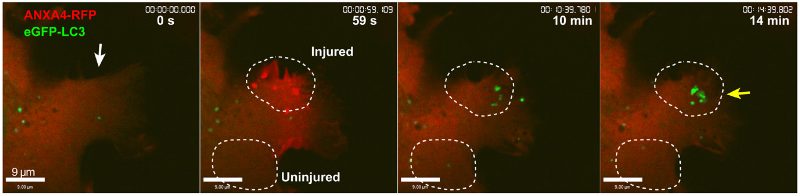
質(zhì)膜受損后出現(xiàn)的LC3小囊泡
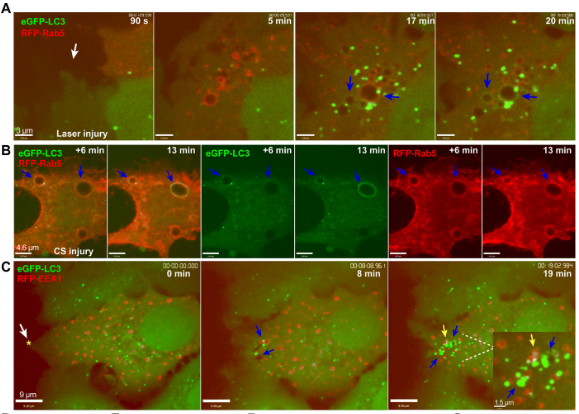
在質(zhì)膜受損處出現(xiàn)的Rab5大囊泡以及兩種囊泡共定位
這些在質(zhì)膜受損后形成的囊泡,究竟承載著怎樣的“使命”?為了探究這個(gè)問(wèn)題,研究人員使用共聚焦延時(shí)成像對(duì)充滿了細(xì)胞外液的Rab5大囊泡的命運(yùn)進(jìn)行了跟蹤,觀察結(jié)果表明,這些囊泡后期會(huì)自發(fā)收縮,并且這種收縮似乎是受囊泡內(nèi)液體的排除驅(qū)動(dòng)的。另外, LC3 陽(yáng)性囊泡隨后似乎將與溶酶體融合,并通過(guò)溶酶體降解系統(tǒng)進(jìn)一步內(nèi)化。
上述情況說(shuō)明,細(xì)胞修復(fù)似乎離不開(kāi)大型胞飲作用。為了驗(yàn)證這一點(diǎn),研究人員使用相關(guān)抑制劑處理了相關(guān)細(xì)胞,此時(shí)細(xì)胞修復(fù)進(jìn)程收到顯著影響, LC3 陽(yáng)性囊泡的形成急劇下降,說(shuō)明巨胞飲作用在細(xì)胞受損后被激活并促進(jìn)了質(zhì)膜重組,而LC3 囊泡則是為了響應(yīng)囊泡內(nèi)化而觸發(fā)的。
簡(jiǎn)而言之,經(jīng)過(guò)消融激光損傷的細(xì)胞,能夠?qū)⑼暾募?xì)胞膜拉入受損區(qū)域,從而在幾分鐘內(nèi)封閉細(xì)胞。隨后,細(xì)胞將通過(guò)大型胞飲作用將受損區(qū)域以囊泡的形式運(yùn)送到細(xì)胞內(nèi)部進(jìn)行“回收利用”,如果該過(guò)程被阻止,細(xì)胞將無(wú)法再修復(fù)損傷并死亡。
值得注意的是,在這項(xiàng)新研究中,研究人員還發(fā)現(xiàn)的質(zhì)膜修復(fù)過(guò)程是通過(guò)觸發(fā)先前未知非典型自噬過(guò)程實(shí)現(xiàn)的。通常,細(xì)胞自噬是由ULK1/ATG13/ WIPI2通路啟動(dòng),但是在這項(xiàng)研究中的細(xì)胞卻“不走尋常路”,并且該過(guò)程與高度依賴(lài)rubicon蛋白的非典型自噬——LC3相關(guān)自噬(LAP)類(lèi)似,研究人員將這種新發(fā)現(xiàn)的非典型自噬過(guò)程稱(chēng)為與LC3相關(guān)的大型胞飲作用(LAM)。
不僅僅是幫助受損細(xì)胞恢復(fù),2020年 Nature Communications 上的一篇文章指出,大型胞飲作用還是腫瘤耐藥的重要原因,而阻斷該過(guò)程能夠恢復(fù)癌細(xì)胞對(duì)藥物的敏感性。

doi.org/10.1038/s41467-020-14928-3
總之,這項(xiàng)研究表明,細(xì)胞在受損后會(huì)觸發(fā)巨胞飲作用來(lái)“療傷”。該報(bào)告的通訊作者、丹麥癌癥協(xié)會(huì)研究中心的Stine Lauritzen Sønder說(shuō):“我們認(rèn)為,癌細(xì)胞在質(zhì)膜受損后通過(guò)巨胞飲作用恢復(fù)的過(guò)程或許并不是終點(diǎn),這可能只是應(yīng)急措施,之后癌細(xì)胞或許進(jìn)行更徹底的修復(fù),而這或許能夠幫助我們發(fā)現(xiàn)癌細(xì)胞的另一個(gè)弱點(diǎn),我們將繼續(xù)探索。”



