摘要:瑞典卡羅林斯卡醫(yī)學院的研究人員近日發(fā)現(xiàn),在阿爾茨海默病的早期階段,大腦海馬體部位的代謝增加。
瑞典卡羅林斯卡醫(yī)學院的研究人員近日發(fā)現(xiàn),在阿爾茨海默病的早期階段,大腦海馬體部位的代謝增加。這一研究成果于11月1日發(fā)表在《Molecular Psychiatry》雜志上,為疾病的早期干預(yù)打開了一扇新的大門。

圖1 腸道細菌產(chǎn)生的短鏈脂肪酸(SCFAs)負責啟動樹突細胞向腸腔延伸
阿爾茨海默病(AD)是最常見的癡呆癥形式,會導(dǎo)致記憶和認知能力衰退。AD患者的大腦特征是蛋白質(zhì)穩(wěn)態(tài)被破壞,包括在細胞外形成淀粉樣蛋白斑塊,在細胞內(nèi)形成神經(jīng)纖維纏結(jié),以及廣泛的神經(jīng)炎癥。
在這項研究中,研究人員使用了淀粉樣前體蛋白(App)基因敲入小鼠模型,以此來再現(xiàn)與阿爾茨海默病有關(guān)的病理特征。他們意外發(fā)現(xiàn),在阿爾茨海默病的早期階段,線粒體的能量代謝成為變化最明顯的通路之一。
在幼齡小鼠代謝增加后,細胞自噬過程受到破壞,導(dǎo)致突觸發(fā)生變化。隨著病變的加劇,大腦會轉(zhuǎn)入代謝低下狀態(tài),突觸前末梢的線粒體豐度降低。晚期小鼠表現(xiàn)出突觸前區(qū)域擴大和局部自噬功能受損。
共同通訊作者、卡羅林斯卡醫(yī)學院神經(jīng)生物學系副教授Per Nilsson稱:“阿爾茨海默病在癥狀出現(xiàn)前20年就開始發(fā)展,因此盡早發(fā)現(xiàn)很重要,尤其是考慮到目前已有緩解病情的藥物。代謝變化可能是一個診斷因素。”
另一名共同通訊作者Maria Ankarcrona教授表示:“有趣的是,在大腦中積累任何特征性的不溶斑塊之前,我們就可以看到代謝的變化。不同的能量平衡與我們在阿爾茨海默病大腦圖像中看到的結(jié)果一致,但如今我們已在早期階段檢測到這些變化。”
這項研究是在兩個研究團隊的密切合作下進行的,他們深入分析了小鼠大腦中被稱為海馬體的部分,海馬體是一個在短期記憶中起重要作用的結(jié)構(gòu),在病理過程的早期受到影響。
研究人員利用RNA測序技術(shù)來觀察海馬體細胞中的哪些基因在疾病的不同階段處于活躍狀態(tài)。他們發(fā)現(xiàn),疾病早期階段的特征是線粒體代謝的增加。
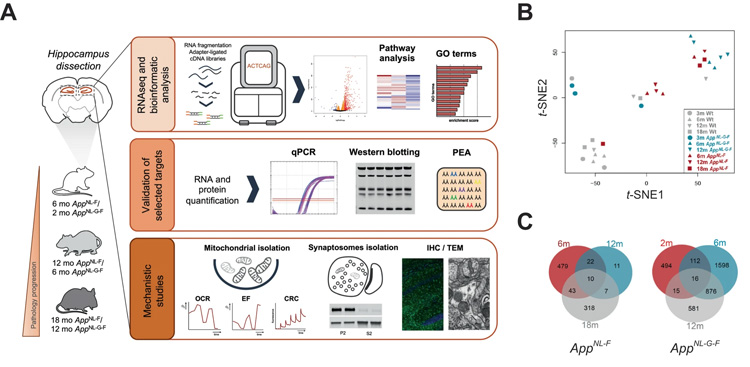
圖2 轉(zhuǎn)錄組分析鑒定了Aβ誘導(dǎo)的小鼠App敲除海馬基因和通路的改變
之后,他們使用電子顯微鏡及其他技術(shù)研究了大腦神經(jīng)元之間的突觸變化,發(fā)現(xiàn)稱為自噬體的囊泡積聚在突觸中,破壞了對功能蛋白質(zhì)的獲取。自噬體的功能是分解使用過的蛋白質(zhì)并代謝其成分。
如今,通過阿爾茨海默病的小鼠模型,研究人員更詳細地研究了線粒體和自噬在疾病進展中的作用。這些數(shù)據(jù)讓他們對病理變化(包括代謝失調(diào)和突觸變化)及其時間順序有了更加全面的了解,從而有望發(fā)現(xiàn)治療阿爾茨海默病的新方法。
“這些發(fā)現(xiàn)強調(diào)了保持線粒體功能和正常蛋白質(zhì)代謝的重要性,” Nilsson博士說。“展望未來,我們將能夠在小鼠身上進行試驗,看看穩(wěn)定線粒體和自噬功能的新分子是否能延緩這種疾病。”
參考資料
[1] Mitochondrial hypermetabolism precedes impaired autophagy and synaptic disorganization in App knock-in Alzheimer mouse models
摘要:瑞典卡羅林斯卡醫(yī)學院的研究人員近日發(fā)現(xiàn),在阿爾茨海默病的早期階段,大腦海馬體部位的代謝增加。
瑞典卡羅林斯卡醫(yī)學院的研究人員近日發(fā)現(xiàn),在阿爾茨海默病的早期階段,大腦海馬體部位的代謝增加。這一研究成果于11月1日發(fā)表在《Molecular Psychiatry》雜志上,為疾病的早期干預(yù)打開了一扇新的大門。

圖1 腸道細菌產(chǎn)生的短鏈脂肪酸(SCFAs)負責啟動樹突細胞向腸腔延伸
阿爾茨海默病(AD)是最常見的癡呆癥形式,會導(dǎo)致記憶和認知能力衰退。AD患者的大腦特征是蛋白質(zhì)穩(wěn)態(tài)被破壞,包括在細胞外形成淀粉樣蛋白斑塊,在細胞內(nèi)形成神經(jīng)纖維纏結(jié),以及廣泛的神經(jīng)炎癥。
在這項研究中,研究人員使用了淀粉樣前體蛋白(App)基因敲入小鼠模型,以此來再現(xiàn)與阿爾茨海默病有關(guān)的病理特征。他們意外發(fā)現(xiàn),在阿爾茨海默病的早期階段,線粒體的能量代謝成為變化最明顯的通路之一。
在幼齡小鼠代謝增加后,細胞自噬過程受到破壞,導(dǎo)致突觸發(fā)生變化。隨著病變的加劇,大腦會轉(zhuǎn)入代謝低下狀態(tài),突觸前末梢的線粒體豐度降低。晚期小鼠表現(xiàn)出突觸前區(qū)域擴大和局部自噬功能受損。
共同通訊作者、卡羅林斯卡醫(yī)學院神經(jīng)生物學系副教授Per Nilsson稱:“阿爾茨海默病在癥狀出現(xiàn)前20年就開始發(fā)展,因此盡早發(fā)現(xiàn)很重要,尤其是考慮到目前已有緩解病情的藥物。代謝變化可能是一個診斷因素。”
另一名共同通訊作者Maria Ankarcrona教授表示:“有趣的是,在大腦中積累任何特征性的不溶斑塊之前,我們就可以看到代謝的變化。不同的能量平衡與我們在阿爾茨海默病大腦圖像中看到的結(jié)果一致,但如今我們已在早期階段檢測到這些變化。”
這項研究是在兩個研究團隊的密切合作下進行的,他們深入分析了小鼠大腦中被稱為海馬體的部分,海馬體是一個在短期記憶中起重要作用的結(jié)構(gòu),在病理過程的早期受到影響。
研究人員利用RNA測序技術(shù)來觀察海馬體細胞中的哪些基因在疾病的不同階段處于活躍狀態(tài)。他們發(fā)現(xiàn),疾病早期階段的特征是線粒體代謝的增加。

圖2 轉(zhuǎn)錄組分析鑒定了Aβ誘導(dǎo)的小鼠App敲除海馬基因和通路的改變
之后,他們使用電子顯微鏡及其他技術(shù)研究了大腦神經(jīng)元之間的突觸變化,發(fā)現(xiàn)稱為自噬體的囊泡積聚在突觸中,破壞了對功能蛋白質(zhì)的獲取。自噬體的功能是分解使用過的蛋白質(zhì)并代謝其成分。
如今,通過阿爾茨海默病的小鼠模型,研究人員更詳細地研究了線粒體和自噬在疾病進展中的作用。這些數(shù)據(jù)讓他們對病理變化(包括代謝失調(diào)和突觸變化)及其時間順序有了更加全面的了解,從而有望發(fā)現(xiàn)治療阿爾茨海默病的新方法。
“這些發(fā)現(xiàn)強調(diào)了保持線粒體功能和正常蛋白質(zhì)代謝的重要性,” Nilsson博士說。“展望未來,我們將能夠在小鼠身上進行試驗,看看穩(wěn)定線粒體和自噬功能的新分子是否能延緩這種疾病。”
參考資料
[1] Mitochondrial hypermetabolism precedes impaired autophagy and synaptic disorganization in App knock-in Alzheimer mouse models



