摘要:麻省理工學院的研究人員認為,在每個細胞核內(nèi),基因組的3D折疊模式?jīng)Q定了基因組的哪些部分將被這些化學修飾標記。
人體內(nèi)的每個細胞都含有相同的基因指令,這些指令編碼在DNA中。然而,在大約3萬個基因中,每個細胞只表達成為神經(jīng)細胞、免疫細胞或體內(nèi)其他數(shù)百種細胞類型中的任何一種所需的基因。
每個細胞的命運主要由裝飾其 DNA 的蛋白質(zhì)的化學修飾決定;這些修飾反過來控制哪些基因被打開或關(guān)閉。然而,當細胞復制它們的DNA進行分裂時,它們失去了一半的這些修飾,留下了一個問題:細胞如何保持它們應該是哪種細胞的記憶?
然而,一些癌癥可以劫持這些途徑為自己的利益。Susanna Stroik博士和Dale Ramsden博士都是北卡羅來納大學醫(yī)學院和北卡羅來納大學Lineberger綜合癌癥中心生物化學和生物物理系的研究人員,他們拼湊出了一條鮮為人知的DNA修復途徑,稱為聚合酶θ介導的末端連接(TMEJ)。
麻省理工學院的一項新研究提出了一個理論模型,該模型有助于解釋細胞分裂時這些記憶是如何代代相傳的。研究小組認為,在每個細胞核內(nèi),基因組的3D折疊模式?jīng)Q定了基因組的哪些部分將被這些化學修飾標記。細胞復制DNA后,標記部分丟失,但3D折疊允許每個子細胞輕松恢復維持其身份所需的化學標記。每次細胞分裂時,化學標記允許細胞恢復其基因組的三維折疊。這樣,通過在3D折疊和標記之間轉(zhuǎn)換記憶,記憶可以在數(shù)百次細胞分裂中保存下來。
該研究的一作、22歲的Jeremy Owen博士說:“細胞類型差異的一個關(guān)鍵方面是不同的基因被打開或關(guān)閉。將一種細胞類型轉(zhuǎn)化為另一種非常困難,因為這些狀態(tài)非常穩(wěn)定,我們在這項工作中所做的是開發(fā)一個簡單的模型,突出細胞內(nèi)化學系統(tǒng)的定性特征,以及它們?nèi)绾喂ぷ鞑拍苁够虮磉_的記憶穩(wěn)定。”
麻省理工學院醫(yī)學工程與科學研究所和物理系的教授Leonid Mirny是該論文的資深作者,該論文今天發(fā)表在《科學》雜志上。

圖1 三維表觀遺傳記憶系統(tǒng)的設(shè)計原理
保持記憶
在細胞核內(nèi),DNA被一種叫做組蛋白的蛋白質(zhì)包裹著,形成被稱為染色質(zhì)的致密結(jié)構(gòu)。組蛋白可以顯示各種修飾,幫助控制哪些基因在給定細胞中表達。這些修飾產(chǎn)生“表觀遺傳記憶”,幫助細胞維持其細胞類型。然而,這種記憶是如何傳遞給子細胞的還是個謎。
Mirny實驗室之前的工作表明,折疊染色體的三維結(jié)構(gòu)部分是由這些表觀遺傳修飾或標記決定的。特別是,他們發(fā)現(xiàn)某些染色質(zhì)區(qū)域,帶有告訴細胞不要讀取特定DNA片段的標記,相互吸引并形成稱為異染色質(zhì)的致密團塊,細胞難以進入。
在他們的新研究中,Mirny和他的同事想要回答這些表觀遺傳標記是如何代代相傳的問題。他們開發(fā)了一個具有幾個標記區(qū)域的聚合物的計算模型,并看到這些標記區(qū)域相互坍塌,形成密集的團塊。然后他們研究了這些標記是如何丟失和獲得的。
當一個細胞復制它的DNA并將其分裂成兩個子細胞時,每個拷貝得到大約一半的表觀遺傳標記。然后,在DNA傳遞給子細胞之前,細胞需要恢復丟失的標記,染色體折疊的方式充當了這些剩余標記應該去哪里的藍圖。
這些修飾是由被稱為“reader-writer讀-寫”酶的特殊酶添加的。這些酶中的每一種都對特定的標記有特異性,一旦它們“讀取”了現(xiàn)有的標記,它們就會在附近的位置“寫入”額外的標記。如果染色質(zhì)已經(jīng)折疊成三維形狀,標記將在已經(jīng)從親本細胞遺傳了修飾的區(qū)域積累。
Owen說:“有幾條證據(jù)表明,傳播可能發(fā)生在三維空間中,這意味著如果有兩個部分在空間上彼此靠近,即使它們不是沿著DNA相鄰,那么傳播也可能從一個部分發(fā)生到另一個部分。這就是3D結(jié)構(gòu)如何影響這些標記的傳播。”
這個過程類似于傳染病的傳播,因為一個染色質(zhì)區(qū)域與其他區(qū)域的接觸越多,它就越有可能被修改,就像一個容易感染某種疾病的人,隨著接觸次數(shù)的增加,更有可能被感染一樣。在這個類比中,異染色質(zhì)密集的區(qū)域就像人們有很多社會互動的城市,而基因組的其余部分就像人口稀少的農(nóng)村地區(qū)。
“這基本上意味著,這些痕跡將在密集區(qū)域無處不在,而在密集區(qū)域之外的任何地方都將非常稀疏。”
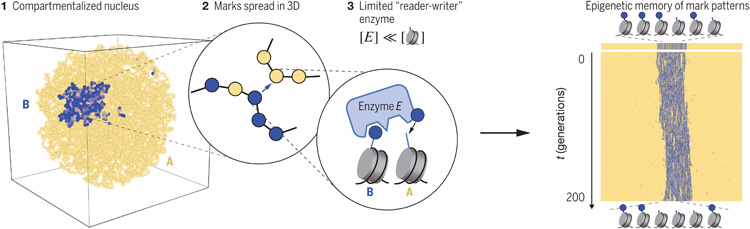
圖2 我們的染色質(zhì)及其在細胞周期中的動力學模型揭示了穩(wěn)定表觀遺傳記憶的三個關(guān)鍵要素
這個新模型表明,存儲在折疊聚合物中的表觀遺傳記憶與存儲在神經(jīng)網(wǎng)絡(luò)中的記憶之間可能存在相似之處。標記的模式可以被認為類似于神經(jīng)網(wǎng)絡(luò)中神經(jīng)元之間形成的連接模式。
Mirny說:“總的來說,這表明類似于神經(jīng)網(wǎng)絡(luò)能夠處理非常復雜的信息的方式,我們所描述的表觀遺傳記憶機制可能能夠處理信息,而不僅僅是存儲信息。”
Epigenetic erosion
雖然這個模型似乎為如何維持表觀遺傳記憶提供了一個很好的解釋,但研究人員發(fā)現(xiàn),最終,讀寫酶的活性將導致整個基因組被表觀遺傳修飾所覆蓋。當他們改變模型使酶變?nèi)鯐r,它不能覆蓋足夠的基因組,記憶在幾代細胞中丟失。
為了使模型更準確地解釋表觀遺傳標記的保存,研究人員增加了另一個因素:限制可用的讀取-寫入酶的數(shù)量。他們發(fā)現(xiàn),如果酶的數(shù)量保持在組蛋白數(shù)量的0.1%到1%之間(這個百分比基于對這些酶的實際豐度的估計),他們的模型細胞可以準確地維持它們的表觀遺傳記憶長達數(shù)百代,這取決于表觀遺傳模式的復雜性。
我們已經(jīng)知道,隨著年齡的增長,細胞開始失去它們的表觀遺傳記憶,研究人員現(xiàn)在計劃研究他們在這篇論文中描述的過程是否可能在表觀遺傳侵蝕和細胞身份喪失中發(fā)揮作用。他們還計劃模擬一種叫做早衰癥的疾病,這種疾病的細胞有基因突變,導致異染色質(zhì)的喪失。患有這種疾病的人會加速衰老。
“這些突變和最終發(fā)生的表觀遺傳變化之間的機制聯(lián)系尚不清楚,使用像我們這樣的模型,其中有動態(tài)標記,以及聚合物動力學,試圖解釋這一點,這將是很好的。”
研究人員還希望合作,通過實驗測試他們模型的一些預測,這可以通過改變活細胞中讀寫酶的水平和測量對表觀遺傳記憶的影響來實現(xiàn)。
這項研究由美國國家人類基因組研究所、美國國家普通醫(yī)學科學研究所和美國國家科學基金會資助。
參考資料
[1] Design principles of 3D epigenetic memory systems
摘要:麻省理工學院的研究人員認為,在每個細胞核內(nèi),基因組的3D折疊模式?jīng)Q定了基因組的哪些部分將被這些化學修飾標記。
人體內(nèi)的每個細胞都含有相同的基因指令,這些指令編碼在DNA中。然而,在大約3萬個基因中,每個細胞只表達成為神經(jīng)細胞、免疫細胞或體內(nèi)其他數(shù)百種細胞類型中的任何一種所需的基因。
每個細胞的命運主要由裝飾其 DNA 的蛋白質(zhì)的化學修飾決定;這些修飾反過來控制哪些基因被打開或關(guān)閉。然而,當細胞復制它們的DNA進行分裂時,它們失去了一半的這些修飾,留下了一個問題:細胞如何保持它們應該是哪種細胞的記憶?
然而,一些癌癥可以劫持這些途徑為自己的利益。Susanna Stroik博士和Dale Ramsden博士都是北卡羅來納大學醫(yī)學院和北卡羅來納大學Lineberger綜合癌癥中心生物化學和生物物理系的研究人員,他們拼湊出了一條鮮為人知的DNA修復途徑,稱為聚合酶θ介導的末端連接(TMEJ)。
麻省理工學院的一項新研究提出了一個理論模型,該模型有助于解釋細胞分裂時這些記憶是如何代代相傳的。研究小組認為,在每個細胞核內(nèi),基因組的3D折疊模式?jīng)Q定了基因組的哪些部分將被這些化學修飾標記。細胞復制DNA后,標記部分丟失,但3D折疊允許每個子細胞輕松恢復維持其身份所需的化學標記。每次細胞分裂時,化學標記允許細胞恢復其基因組的三維折疊。這樣,通過在3D折疊和標記之間轉(zhuǎn)換記憶,記憶可以在數(shù)百次細胞分裂中保存下來。
該研究的一作、22歲的Jeremy Owen博士說:“細胞類型差異的一個關(guān)鍵方面是不同的基因被打開或關(guān)閉。將一種細胞類型轉(zhuǎn)化為另一種非常困難,因為這些狀態(tài)非常穩(wěn)定,我們在這項工作中所做的是開發(fā)一個簡單的模型,突出細胞內(nèi)化學系統(tǒng)的定性特征,以及它們?nèi)绾喂ぷ鞑拍苁够虮磉_的記憶穩(wěn)定。”
麻省理工學院醫(yī)學工程與科學研究所和物理系的教授Leonid Mirny是該論文的資深作者,該論文今天發(fā)表在《科學》雜志上。

圖1 三維表觀遺傳記憶系統(tǒng)的設(shè)計原理
保持記憶
在細胞核內(nèi),DNA被一種叫做組蛋白的蛋白質(zhì)包裹著,形成被稱為染色質(zhì)的致密結(jié)構(gòu)。組蛋白可以顯示各種修飾,幫助控制哪些基因在給定細胞中表達。這些修飾產(chǎn)生“表觀遺傳記憶”,幫助細胞維持其細胞類型。然而,這種記憶是如何傳遞給子細胞的還是個謎。
Mirny實驗室之前的工作表明,折疊染色體的三維結(jié)構(gòu)部分是由這些表觀遺傳修飾或標記決定的。特別是,他們發(fā)現(xiàn)某些染色質(zhì)區(qū)域,帶有告訴細胞不要讀取特定DNA片段的標記,相互吸引并形成稱為異染色質(zhì)的致密團塊,細胞難以進入。
在他們的新研究中,Mirny和他的同事想要回答這些表觀遺傳標記是如何代代相傳的問題。他們開發(fā)了一個具有幾個標記區(qū)域的聚合物的計算模型,并看到這些標記區(qū)域相互坍塌,形成密集的團塊。然后他們研究了這些標記是如何丟失和獲得的。
當一個細胞復制它的DNA并將其分裂成兩個子細胞時,每個拷貝得到大約一半的表觀遺傳標記。然后,在DNA傳遞給子細胞之前,細胞需要恢復丟失的標記,染色體折疊的方式充當了這些剩余標記應該去哪里的藍圖。
這些修飾是由被稱為“reader-writer讀-寫”酶的特殊酶添加的。這些酶中的每一種都對特定的標記有特異性,一旦它們“讀取”了現(xiàn)有的標記,它們就會在附近的位置“寫入”額外的標記。如果染色質(zhì)已經(jīng)折疊成三維形狀,標記將在已經(jīng)從親本細胞遺傳了修飾的區(qū)域積累。
Owen說:“有幾條證據(jù)表明,傳播可能發(fā)生在三維空間中,這意味著如果有兩個部分在空間上彼此靠近,即使它們不是沿著DNA相鄰,那么傳播也可能從一個部分發(fā)生到另一個部分。這就是3D結(jié)構(gòu)如何影響這些標記的傳播。”
這個過程類似于傳染病的傳播,因為一個染色質(zhì)區(qū)域與其他區(qū)域的接觸越多,它就越有可能被修改,就像一個容易感染某種疾病的人,隨著接觸次數(shù)的增加,更有可能被感染一樣。在這個類比中,異染色質(zhì)密集的區(qū)域就像人們有很多社會互動的城市,而基因組的其余部分就像人口稀少的農(nóng)村地區(qū)。
“這基本上意味著,這些痕跡將在密集區(qū)域無處不在,而在密集區(qū)域之外的任何地方都將非常稀疏。”

圖2 我們的染色質(zhì)及其在細胞周期中的動力學模型揭示了穩(wěn)定表觀遺傳記憶的三個關(guān)鍵要素
這個新模型表明,存儲在折疊聚合物中的表觀遺傳記憶與存儲在神經(jīng)網(wǎng)絡(luò)中的記憶之間可能存在相似之處。標記的模式可以被認為類似于神經(jīng)網(wǎng)絡(luò)中神經(jīng)元之間形成的連接模式。
Mirny說:“總的來說,這表明類似于神經(jīng)網(wǎng)絡(luò)能夠處理非常復雜的信息的方式,我們所描述的表觀遺傳記憶機制可能能夠處理信息,而不僅僅是存儲信息。”
Epigenetic erosion
雖然這個模型似乎為如何維持表觀遺傳記憶提供了一個很好的解釋,但研究人員發(fā)現(xiàn),最終,讀寫酶的活性將導致整個基因組被表觀遺傳修飾所覆蓋。當他們改變模型使酶變?nèi)鯐r,它不能覆蓋足夠的基因組,記憶在幾代細胞中丟失。
為了使模型更準確地解釋表觀遺傳標記的保存,研究人員增加了另一個因素:限制可用的讀取-寫入酶的數(shù)量。他們發(fā)現(xiàn),如果酶的數(shù)量保持在組蛋白數(shù)量的0.1%到1%之間(這個百分比基于對這些酶的實際豐度的估計),他們的模型細胞可以準確地維持它們的表觀遺傳記憶長達數(shù)百代,這取決于表觀遺傳模式的復雜性。
我們已經(jīng)知道,隨著年齡的增長,細胞開始失去它們的表觀遺傳記憶,研究人員現(xiàn)在計劃研究他們在這篇論文中描述的過程是否可能在表觀遺傳侵蝕和細胞身份喪失中發(fā)揮作用。他們還計劃模擬一種叫做早衰癥的疾病,這種疾病的細胞有基因突變,導致異染色質(zhì)的喪失。患有這種疾病的人會加速衰老。
“這些突變和最終發(fā)生的表觀遺傳變化之間的機制聯(lián)系尚不清楚,使用像我們這樣的模型,其中有動態(tài)標記,以及聚合物動力學,試圖解釋這一點,這將是很好的。”
研究人員還希望合作,通過實驗測試他們模型的一些預測,這可以通過改變活細胞中讀寫酶的水平和測量對表觀遺傳記憶的影響來實現(xiàn)。
這項研究由美國國家人類基因組研究所、美國國家普通醫(yī)學科學研究所和美國國家科學基金會資助。
參考資料
[1] Design principles of 3D epigenetic memory systems



